Blant de intermolekylære kreftene er induserte dipol-induserte dipolkrefter de er de eneste som ikke er studert av den nederlandske fysikeren Johannes Diederik Van der Waals (1837-1923). De ble belyst av den tyske fysikeren Fritz Wolfgang London (1900-1954), så disse kreftene kalles også london styrker eller london spredningskrefter. Et annet navn gitt til disse kreftene er øyeblikkelig dipol-indusert dipol.
Denne typen kraft oppstår i ikke-polare stoffer, slik som H2, O2, F2, Cl2, CO2, CH4 og C2H6, blant andre. Og de kan også oppstå mellom edelgassatomer, når de nærmer seg, forårsaker frastøting mellom elektrosfærene deres. På denne måten samler elektronene seg på en bestemt side, som er negativt polarisert og motsatt side positivt, på grunn av den negative ladningsmangelen.
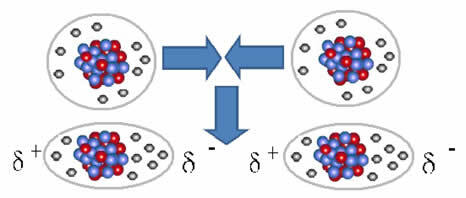
Ikke-polare molekyler kan gå fra en gassform - der de er veldig langt fra hverandre og det er ingen interaksjon, siden det ikke er poler - til en flytende og fast tilstand. I disse aggregeringstilstandene er molekylene nærmere og de elektroniske attraksjonene eller frastøtningene mellom deres elektroner og kjerner kan føre til en deformasjon av deres elektroniske skyer, momentant, med opprinnelse positive og negative poler midlertidig.
Øyeblikkelige dipoler kan indusere polarisering av nærliggende molekyler, noe som resulterer i attraktive krefter.
Ikke stopp nå... Det er mer etter reklamen ;)
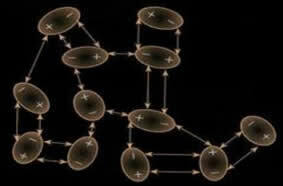
Denne induksjonen kan også forekomme. mellom ulike molekyler og generelt disse kreftene er svakere i intensitet enn dipol-dipol- og hydrogenbindingsstyrkene. Derfor er faste stoffer med denne interaksjonsstyrken som tørris (karbondioksid - CO2) og jod (I2), som er i fast tilstand, sublime (gå til gassform); fordi energien som trengs for å forstyrre interaksjonene deres er liten.
Et eksempel på intermolekylære krefter mellom polare og ikke-polare molekyler oppstår mellom oksygengass (ikke-polar) og vann (polar). Det viser seg at den negative enden av vannet nærmer seg O2 og frastøter seg selv, og dermed beveger den elektroniske skyen til det ikke-polare molekylet seg bort. Oksygenet blir deretter midlertidig polarisert og begynner å samhandle med vannet og løses opp i det.
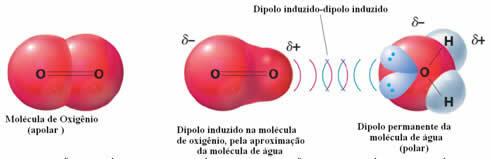
Siden disse kreftene er svake, er løseligheten til denne gassen i vann liten. Likevel er tilstedeværelsen avgjørende for å bevare livet til ulike vannlevende organismer.
Denne interaksjonskraften forekommer også i naturen, og gir adherens mellom gekkoenes poter og overflaten de går på. Derfor kan de gå på vegger og tak uten å falle eller feste seg.
Av Jennifer Fogaça
Uteksaminert i kjemi
Brasil skolelag
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
FOGAÇA, Jennifer Rocha Vargas. "Induserte dipol-induserte dipol- eller London-spredningskrefter"; Brasil skole. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/forcas-dipolo-induzido-dipolo-induzido-ou-dispersao-london.htm. Åpnet 27. juli 2021.