DE pastaatomisk, som navnet antyder, er det massen til et atom, vanligvis symbolisert med "mDe” eller “MA”. Men siden atomet er en ekstremt liten enhet, usynlig for menneskelige øyne, er det ikke mulig å måle massen ved hjelp av for eksempel vekter. Så forskere bestemte massen av atomer ved å sammenligne dem med massene til andre atomer.
Dette gjøres også med de andre enhetene. For eksempel er masseenheten standardkilogrammet, som tilsvarer en sylinder på 3,917 cm i høyde og diameter, laget av 10 % iridium og 90 % platina. Så det fungerer som en sammenligning. For eksempel, hvis vi "veier" en gjenstand på en skala og vi finner at massen er 10 kg, betyr det at massen er 10 ganger større enn den valgte standarden: 1 kg.
Det samme gjelder atomer. Standarden som ble valgt var karbon-12, og dette atomet ble vilkårlig tildelt en masse på 12 u. "u" er enheten for atommasse og tilsvarer derfor 1/12 massen til et karbonatom.
For eksempel, når vi sier at atommassen til hydrogen er lik 1 u, betyr det at det er som om hvis vi deler karbonet i 12 deler, tilsvarer massen til en av disse delene massen til atomet til hydrogen. Et annet eksempel er svovel, dens atommasse er 32 u, noe som betyr at massen er 32 ganger større enn 1/12 av massen til
12Ç.1 u = 1/12 av massen til 1 karbonatom 12

Atommasseenheten er 1/12 massen til karbon-12
Molekylmassen til stoffer er summen av grunnstoffenes atommasser. For eksempel er atommassen til oksygen lik 16 u, så molekylmassen til oksygengassmolekylet (O2) er lik 32u.
Ettersom laboratorieteknikker for tiden er svært avanserte, finnes det enheter som nøyaktig måler atommassen til grunnstoffer, for eksempel massespektrometeret. Dermed er det mulig å vite det 1 u er lik 1,66054. 10-24 g.
Tankekart: Atommasse

*For å laste ned tankekartet i PDF, Klikk her!
Siden atommasser bestemmes med stor presisjon, er de gitt i det periodiske systemet i form av desimaltall. Men når vi skal gjøre beregningene, bruker vi vanligvis det avrundede tallet, med unntak av eksperimenter som må være veldig presise. Hvis du for eksempel ser på det periodiske systemet, vil du se at atommassen til oksygen er lik 15 999 u, men vi bruker generelt verdien 16 u i beregningene. Dette skjer også med karbon, hvis atommasse er gitt av 12,01 u, som vist nedenfor:
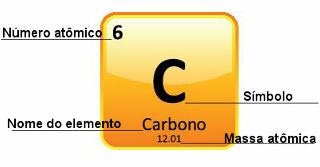
Representasjon av karbon i det periodiske system
Grunnstoffene som vises i det periodiske systemet er faktisk det vektede gjennomsnittet av alle grunnstoffets naturlige isotoper. Dermed er atommassen som vises i tabellen også gjennomsnittet av atommassene til disse elementene. For eksempel har klor (C?) to naturlige isotoper, 35 og 37, hvis respektive prosentandeler i naturen er 75,76 % og 24,24 %. Atommassene til hver av disse isotopene er forskjellige, med den for Cβ-35 er 34,96885 u og den til Cβ-37 er 36,96590.
På denne måten beregnes atommassen til elementet under hensyntagen til massen til hver isotop og overfloden som den vises med i naturen. Når det gjelder klor, har vi:
Atommassen til grunnstoffet klor = (34,96885. 75,76%) + (36,96590. 24,24%)
100%
Atommassen til grunnstoffet klor = 35,45
Dette er atommasseverdien til klor som vises i det periodiske system.
* Tankekart av Me. Diogo Lopes
Av Jennifer Fogaça
Uteksaminert i bokstaver
Kilde: Brasil skole - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-massa-atomica.htm
