Oksidasjon er navnet gitt til prosessen med tap av elektroner av et atom, gruppe eller ioniske arter i løpet av en kjemisk reaksjon. Det identifiseres fra økningen i NOX (oksidasjonsnummer) av arten eller atomet når man sammenligner reaktant og produkt.
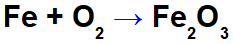
Jernoksidasjonsligning.
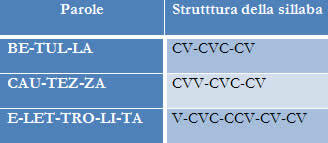
I ligningen ovenfor kan vi for eksempel indikere NOX for hver av deltakerne:
Reagensjern (Fe): har NOX 0 da det er en enkelt stoff;
Oksygen i reagens (O): har NOX 0 da det er et enkelt stoff;
Oksygen i produktet: det har NOX -2 fordi det ikke er knyttet til et alkalimetall, jordalkali eller hydrogendannende peroksider eller superoksider;
Jern i produktet: det har NOX +3 fordi summen av NOX til jern multiplisert med 2 (antall atomer) + NOX av oksygen multiplisert med 3 må resultere i 0 da det er et sammensatt stoff:
x, 2 + 3.(-2) = 0
2x - 6 = 0
2x = +6
x = + 6
2
x = +3
Ved å sammenligne NOX til reagensjernet (0) med produktet (+3), observerte vi en økning, det vil si at det gjennomgikk prosessen med oksidasjon. Det er verdt å merke seg at forekomsten av
oksidasjon det er alltid ledsaget av fenomenet reduksjon (som betyr forsterkningen av elektroner), identifisert av reduksjonen i NOx, som skjer med oksygen i eksemplet.Les også:Bestemmelse av oksidasjonsnummer (NOX)
Eksempler på situasjoner der oksidasjon oppstår:
1. Forbrenning

Forbrenningen av et materiale er også en indikasjon på oksidasjon.
Forbrenning er hver kjemisk reaksjon som skjer i nærvær av en brensel hvilken som helst og den oksiderende oksygengassen (O2), noe som resulterer i produksjon av varme og lys. I hver forbrenningsreaksjon oppstår oksidasjon.
2. Noen organiske reaksjoner
I hver organisk reaksjon som finner sted i nærvær av midlene som er oppført nedenfor, prosessen med oksidasjon:
Kaliumdikromat (K2Cr2O7) eller kaliumpermanganat (KMnO4);
Tilstedeværelse av sterk syre eller sterk base;
Ozongass (O3) i nærvær av metallisk sink (Zn) og vann (H2O).
3. Batterier eller batterier

Batterier er enheter der oksidasjon alltid forekommer.
Stabler eller batterier er elektrokjemiske enheter som lagrer kjemiske stoffer. Ett av disse stoffene vil gjennomgå oksidasjon, og det andre vil gjennomgå reduksjon, noe som resulterer i produksjon av elektrisk strøm.
4. Elektrolyse
Elektrolyse er en kjemisk prosess der en vandig løsning som inneholder et salt blir utsatt for en elektrisk strøm, som ender opp med å fremme oksidasjonen av anioner som er tilstede i disse materialene. I all elektrolyse er det oksidasjon.
Av meg Diogo Lopes Dias
Kilde: Brasil skole - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-oxidacao.htm