Osmose er bevegelse av vann som foregår inne i cellene gjennom en semipermeabel membran.
I denne prosessen beveger vannmolekylene seg fra et mindre konsentrert medium til et mer konsentrert medium.
Derfor tjener osmose til å balansere de to sidene av membranen, noe som fører til at det løsningsrike mediet blir fortynnet av løsningsmidlet, som er vann.
Hvordan oppstår osmose?
Osmose betraktes som en passiv transport, som i passasjen gjennom membranen ingen energi er bortkastet.
I osmoseprosessen har vann, som er løsningsmidlet, en tendens til å krysse den semipermeable membranen for å balansere konsentrasjonen av løsningen. Denne handlingen utføres til det osmotiske trykket er stabilisert.
Derfor beveger vannet seg fra det mindre konsentrerte området til det mer konsentrerte, naturlig.
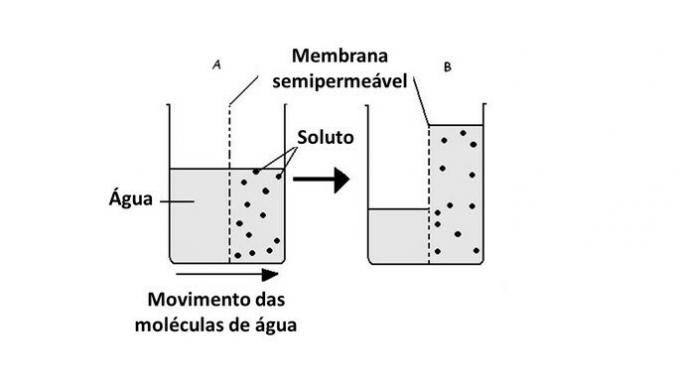
Passering av vann fra ett medium til et annet skjer i celler ved hjelp av transport av proteiner i membranen, aquaporiner. Dermed oppstår osmose når det er en forskjell i konsentrasjon mellom cellens ytre og indre miljø.
Resultatet av osmose brukes i næringsutvekslingsprosessene til dyre- og planteceller.
Les også om Passiv transport og Aktiv transport.
Hypotonisk, isotonisk og hypertonisk løsning
Som vi har sett, tar osmoseprosessen sikte på å utjevne konsentrasjonene av løsninger, til en likevekt er nådd. For dette har vi følgende typer løsninger:
- hypertonisk løsning: presenterer høyere osmotisk trykk og konsentrasjon av løsemiddel.
- hypotonisk løsning: presenterer lavere osmotisk trykk og konsentrasjon av løsemiddel.
- isoton løsning: den oppløste konsentrasjonen og det osmotiske trykket er like, og oppnår dermed likevekt.
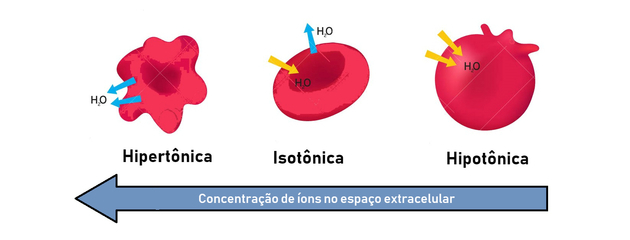
Derfor oppstår osmose mellom en hypertonisk (mer konsentrert) og hypotonisk (mindre konsentrert) måte å generere en balanse på.
eksempler på osmose
I celler er plasmamembranen en konvolutt dannet av et lipiddobbelag, som hindrer bevegelsen av vann i cellen. Imidlertid er det proteiner som er spesialisert i strukturen, aquaporiner, som fungerer som kanaler som letter passasjen av vannmolekyler.
I et hypertonisk miljø har celler en tendens til å krympe når de mister vann. En celle plassert i et hypotonisk medium kan hovne opp til den går i stykker, da det er bevegelse av vann inn i cellen.
Se nedenfor hvordan osmose oppstår i dyre- og planteceller.
Osmose i dyrecelle
når en dyrecelle, i likhet med røde blodlegemer, utsettes for medier med forskjellige konsentrasjoner, forekommer bevegelsen av vann i cellen som følger:
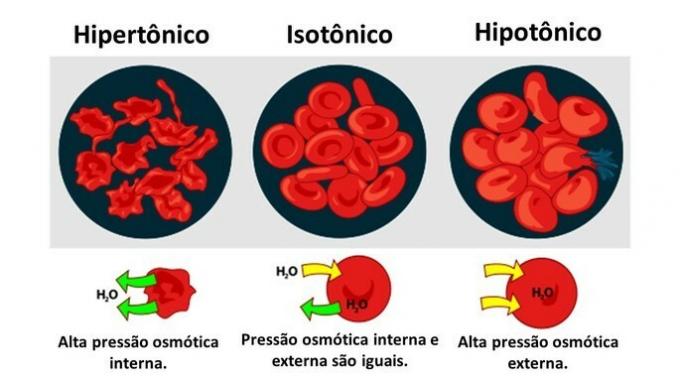
Når mediet er rik på oppløst stoff, en løsning som er hypertonisk med hensyn til cytoplasmaet, mister celler vann til mediet og visner.
Når mediet har dårlig oppløsningsmiddel, en hypoton løsning, har vannmolekyler en tendens til å komme inn i cellen, og selv om membranen er motstandsdyktig, kan avbrudd oppstå avhengig av mengden.
Plantecelle osmose
Bevegelsen av vann i planteceller foregår mellom den cellulære vakuolen og det ekstracellulære miljøet.
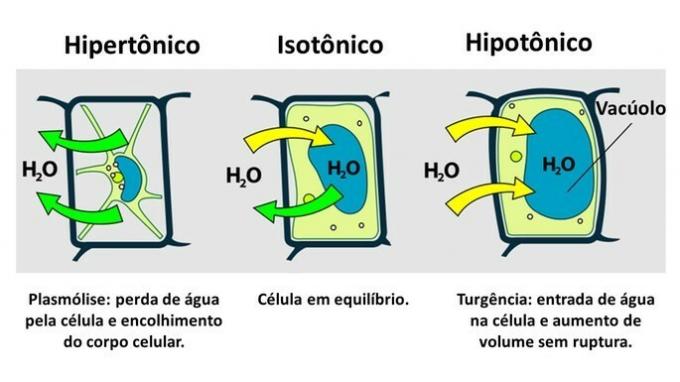
DE Plante-celle den har i tillegg til plasmamembranen en meget motstandsdyktig cellevegg som dannes av cellulose.
Derfor, i motsetning til dyrecellen, motstår plantecellen forstyrrelser når den settes inn i et hypotonisk miljø, der vann har en tendens til å komme inn i cellen. Cellen svulmer og øker volumet, men celleveggen forhindrer brudd.
Tap av vann av en plantecelle, som settes inn i et hypertonisk miljø, kalles plasmolyse. Inntreden av vann i vakuolen når cellen er i et hypotonisk medium kalles nødsituasjoner når det er en økning i cellevolumet.
Hvordan påvirker osmotisk trykk osmose?
En oppløst stoff er ethvert stoff som kan fortynnes i et løsningsmiddel, for eksempel sukker oppløst i vann. Mens osmotisk trykk er trykket som gjøres for at vannet skal bevege seg.
Ettersom osmose er en prosess som oppstår fra det minst konsentrerte (hypotoniske) til det mest konsentrerte (hypertoniske) mediet i søke etter balanse, er osmotisk trykk trykket som utøves på et system for å forhindre at osmose skjer naturlig.
Derfor, jo større konsentrasjonsforskjell mellom hypertonisk og hypotonisk medium, desto større bør det osmotiske trykket påføres på den mer konsentrerte løsningen for å unngå osmose.
Lære mer om osmotisk trykk.
Hva er omvendt osmose og hvordan det fungerer
Omvendt osmose er passering av vann i motsatt retning av osmose. Dermed beveger vann seg fra en mer konsentrert løsning til en mindre konsentrert løsning.
Omvendt osmose finner sted ved å legge et trykk større enn det naturlige osmotiske trykket.
Ettersom den semipermeable membranen bare tillater passering av løsningsmiddel (rent vann), beholder den oppløste stoffer.
Et eksempel på omvendt osmose er transformasjonen av saltvann til ferskvann ved avsaltingsprosessen.
Lære mer om omvendt osmose.
Forskjellen mellom osmose og diffusjon
Diffusjon er passasje av veldig små molekyler av gasser og oppløste stoffer oppløst i vann gjennom plasmamembran. I dette tilfellet vil de oppløste molekylene skifte fra det mer konsentrerte mediet til det mindre konsentrerte mediet. De beveger seg langs en konsentrasjonsgradient og sprer seg over tilgjengelig plass.
DE tilrettelagt for diffusjon det er passering gjennom membranen av stoffer som ikke oppløses i lipider, ved hjelp av proteiner som gjennomsyrer lipid-dobbeltlaget.
I likhet med osmose regnes diffusjon også som en passiv transport, da det skjer til fordel for en konsentrasjonsgradient.
Nysgjerrighet
Uttrykket "læring ved osmose" er mye brukt av studenter som ønsker å lære nytt innhold uten å måtte studere, det vil si uten å gjøre en innsats.
Les også:
- Oppløsningsmiddel og løsemiddel
- Sodium and Kalium Pump
- Selektiv permeabilitet

