Elektrolyse er en fysisk-kjemisk prosess som bruker elektrisk energi fra hvilken som helst kilde (for eksempel batteri eller batteri) for å tvinge forekomsten av en kjemisk reaksjon til å produsere enkle eller sammensatte stoffer som ikke finnes i naturen eller som ikke finnes i store mengder.
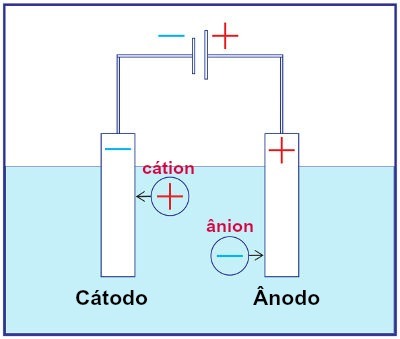
Representasjon av monteringen av et hvilket som helst elektrolysesystem
Under elektrolyse gjennomgår en kation reduksjon ved katoden, og et anion gjennomgår oksidasjon ved anoden. Dette skjer gjennom elektrisk utladning fra en ekstern kilde. Dermed har vi i en elektrolyse en ikke-spontan oksidasjons- og reduksjonsreaksjon.
Forstå nå de to måtene elektrolyse skjer på:
I denne typen elektrolyse bruker vi a ionisk stoff i flytende tilstand i et elektrolytisk kar. Når det ioniske stoffet (XY) gjennomgår fusjon, gjennomgår det prosessen med dissosiasjon, som representert nedenfor:
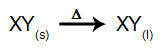

Når kilden er slått på, kation (X+) beveger seg mot katoden, og anionene (Y-) bevege seg mot anoden. Derved:
Ved katoden: kationene mottar elektroner (de gjennomgår reduksjon) og transformeres til en stabil substans (X), en prosess representert ved følgende ligning:
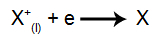
Ved anoden: anioner mister elektroner (de gjennomgår oksidasjon) og blir en stabil substans (X), en prosess representert av følgende ligning:

a) Eksempel på magmatisk elektrolyse
Som et eksempel, følg nå den magmatiske elektrolysen av natriumklorid (NaCl). Når natriumklorid (NaCl) gjennomgår fusjon, gjennomgår det dissosiasjonsprosessen, som vist nedenfor:
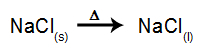
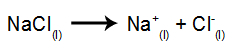
Så når strømkilden er slått på, blir kationet (Na+) beveger seg mot katoden, og anionene (Cl-) bevege seg mot anoden. Derved:
Ved katoden: kationene i+ de mottar elektroner (de gjennomgår reduksjon) og blir en stabil substans (Na, som er et fast metall), en prosess representert ved ligningen nedenfor:

Ved anoden: Cl-anionene- de mister elektroner (de gjennomgår oksidasjon) og blir en stabil substans (Cl2, som er gassformet), prosess representert ved ligningen nedenfor:

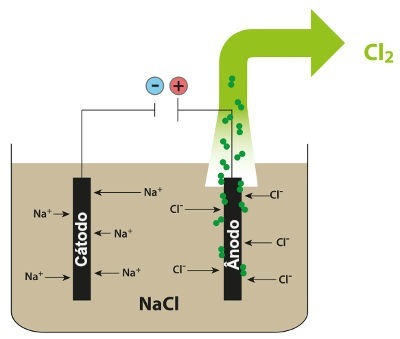
Skjema som viser den magmatiske elektrolysen av NaCl
I den magmatiske elektrolysen av natriumklorid har vi således dannelsen av metallisk natrium (Na) og klorgass (Cl2).
I denne typen elektrolyse bruker vi et ionisk stoff oppløst i vann, inne i den elektrolytiske tanken. Så før vi utfører elektrolysen, blander vi først stoffet (vanligvis et salt uorganisk) i vann for å forårsake dissosiasjon (frigjøring av et kation og et anion), som vist nedenfor:
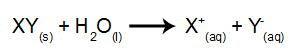
Forskjellen i forhold til magmatisk elektrolyse er at vi, i tillegg til ionene fra dissosiasjon, også har ioner fra selvioniseringen av vann. I sin selvionisering produserer vann en hydroniumkation (H+) og et hydroksidanion (OH-), som i ligningen nedenfor:

Således, inne i det elektrolytiske karet, har vi tilstedeværelse av to kationer (ett fra stoffet ionisk og en fra vann) og to anioner (den ene fra den ioniske substansen og den andre fra Vann).
For å vite hvilken kation som vil bevege seg til katoden og hvilken anion som vil bevege seg til anoden, er det nødvendig å vite rekkefølgen på utslipp av kationer og anioner.
For kationer:
Au> Pt> Hg> Ag> Cu> Ni> Cd> Pb> Fe> Zn> Mn> hydronium> IIIA-familie> IIA-familie> IA-familie
for anioner
Ikke-oksygenerte anioner og HSO4 > hydroksid> oksygenerte anioner og F
Deretter, når strømkilden er slått på, kommer et kation (X+) beveger seg mot katoden, og en av anionene (Y-) beveger seg mot anoden.
Ved katoden: kationene mottar elektroner (de gjennomgår reduksjon) og transformeres til en stabil substans (X), en prosess representert ved ligningen nedenfor:

Ved anoden: anioner mister elektroner (de gjennomgår oksidasjon) og blir en stabil substans (Y), en prosess representert ved ligningen nedenfor:
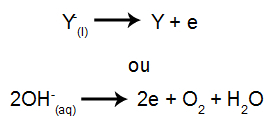
a) Eksempel på vandig elektrolyse
Som et eksempel vil vi bruke den vandige elektrolysen av natriumklorid (NaCl). Når natriumklorid (NaCl) er oppløst i vann, gjennomgår det dissosieringsprosessen, som vist nedenfor:
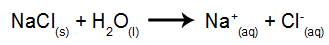
I tillegg til dissosiasjonen av NaCl, har vi selvionisering av vann:

Så vi har H-kationene+ og på+ og OH-anionene- og Cl-. Når strømkilden er slått på, har vi følgende:
ved katoden: H-kationene+ motta elektroner (redusert) og bli en stabil substans (H2, som er en gass). Dette er fordi hydronium har utslippsprioritet over elementene i IA-familien (i dette tilfellet Na). Prosessen er representert ved ligningen nedenfor:
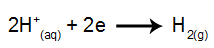
ved anode: Cl-anionene- de mister elektroner (de gjennomgår oksidasjon) og blir en stabil substans (Cl2, som er gassformet). Dette er fordi Cl- det er et ikke-oksygenert anion og har utslippsprioritet fremfor hydroksid, en prosess representert ved ligningen nedenfor:


Skjema som viser den vandige elektrolyse av NaCl
Dermed har vi i den vandige elektrolysen av natriumklorid dannelsen av hydrogengass (H2) og klorgass (Cl2).
Av meg. Diogo Lopes Dias
Kilde: Brasilskolen - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-eletrolise.htm

