For at du skal forstå fenomenet ionisering det er først nødvendig å vite hva ioner er. Legg merke til forklaringen nedenfor:
Hvert atom har samme antall protoner og elektroner; derfor er hvert atom elektrisk nøytralt. Videre har stoffer dannet av grupper av atomer også en elektrisk ladningsbalanse, som er elektrisk nøytral.
derimot, et atom eller en gruppe atomer kan miste eller få elektroner; når det skjer, mister de nøytralitet og blir ioner.
Hvis atomet eller gruppen av atomer mister elektroner, vil det være positivt ladet og vil være et ion som kalles kation. Men hvis du får elektroner, vil ladningen være negativ og ionet vil være a anion.
Uorganiske stoffer er ioniske eller har evnen til å danne ioner.
En av måtene å danne ioner er ved å plassere molekylære stoffer i vann, det vil si dannet av kovalente bindinger, hvor elektroner deles.
For eksempel hvis vi tester den elektriske ledningen av saltsyre (HCl) i vandig løsning (hydrogenklorid oppløst i vann), vil vi se at løsningen er elektrolytisk, det vil si at den leder en elektrisk strøm, fordi det er ioner i dette løsning.

Dette betyr at vann fungerte som en reaktant og dannet ioner fra saltsyre. Dette skjer i henhold til reaksjonen nedenfor:
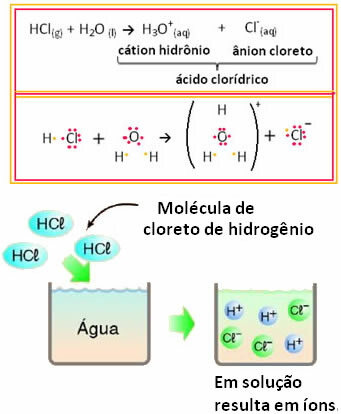
Vær oppmerksom på at det ikke var ioner før du satte hydrogenklorid i vann. Imidlertid reagerte molekylene med vann og dannet positive H-ioner3O+ (kationer) og negativer Cl- (anioner). Siden klor er mer elektronegativ enn hydrogen, tiltrekker det paret elektroner fra den kovalente bindingen nær det og danner anionet. Hydrogen tiltrekkes derimot av oksygen i vann, som er mer elektronegativt enn klor; og mellom hydrogen og oksygen dannes en kovalent binding som gir hydroniumkation. Dette fenomenet iondannelse kallesionisering.
Basert på forklaringen ovenfor kan vi definere ionisering som følger:

Legg merke til at ionene ikke eksisterte før, for hvis de eksisterte, som i tilfelle av oppløsningen av ioniske forbindelser, ville vi ha en ionisk dissosiasjon og ikke en ionisering.
Alle syrer som er i kontakt med vann gjennomgår ionisering. Imidlertid gjennomgår ikke alle molekylære forbindelser ionisering.For eksempel sukker (C12H22O11) er molekylært, men når det plasseres i vann, dannes ingen ioner, det oppløses bare og har en ikke-elektrolytisk molekylær løsning som ikke leder elektrisitet.
Av Jennifer Fogaça
Uteksamen i kjemi