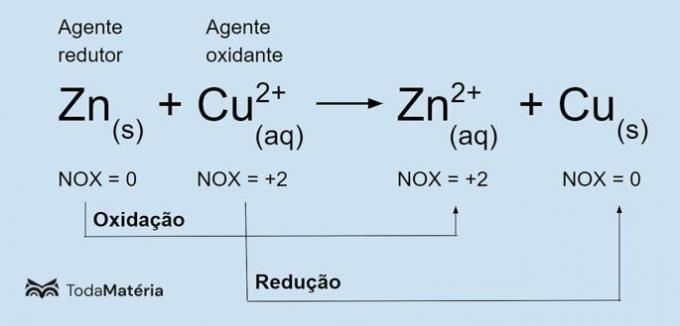
Endotermiske og eksoterme reaksjoner er mengder som måler mengden varme (energi) som absorberes og frigjøres under kjemiske reaksjoner. De studeres av termokjemi.
Hva er forskjellen mellom dem?
endoterm reaksjon er den der det er energiabsorpsjon. I denne prosessen produseres energi og vedlikeholdes uavhengig.
Fugler og pattedyr har evnen til å opprettholde stabil kroppstemperatur. Av denne grunn kalles de endotermiske dyr, populært "varmblodige dyr".
Eksoterm reaksjon er den der det frigjøres energi. I denne prosessen vedvarer energiproduksjonen bare gjennom kontinuerlig tilførsel av energi.
Endring av fysiske tilstander, i den rekkefølgen: gass, væske og fast stoff, er et eksempel på en eksoterm reaksjon. Hver av dem oppstår når energi frigjøres, det vil si når det er mindre varme.
Merk at når vi snur denne ordren (fast, væske og gass), produseres energi (mer varme). I dette tilfellet er reaksjonen endoterm.
Hverdagseksempler
Kroppsfett fungerer som drivstoff i kroppen vår. Den som ikke blir brent, blir absorbert av den. Siden dette er en absorpsjonsprosess, er det et eksempel på en endoterm reaksjon.
Når vi legger en panne på ilden for å tilberede mat, står vi i sin tur overfor en eksoterm prosess. Det er fordi varmen som frigjøres vil transformere denne maten slik at den kan konsumeres.
Og hva er entalpi?
entalpi det er energien som finnes i alle stoffer og som endres som et resultat av endotermiske og eksoterme reaksjoner.
Siden det ikke er mulig å beregne entalpi, ble beregningen av variasjonen etablert.
Ved å sammenligne standard entalpi (temperatur på 25 ° C under atmosfæretrykk på 1 atm), vil det være mulig å beregne entalpi-variasjonen.
Ifølge Hess 'lov, den siste entalpi minus den første entalpi (ΔH = Hf - HJeg) resulterer i disse dataene.
Hvis den endotermiske reaksjonen absorberer energi, betyr dette at entalpi av den (endelige) reaktanten er lavere enn for det (opprinnelige) produktet. Derfor er entalpiendringen positiv (ΔH> 0).
Hvis den eksoterme reaksjonen frigjør energi, betyr det i sin tur at entalpi (energi) til reaktanten er større enn produktets. Derfor er entalpievariasjonen negativ (ΔH
Les også:
- Kjemiske reaksjoner
- Kjemisk balanse
- Forbrenning