Syrer og baser er to kjemiske grupper relatert til hverandre. De er to stoffer av stor betydning og til stede i hverdagen.
Syrer og baser er studert av Inorganic Chemistry, grenen som studerer forbindelser som ikke er dannet av karbon.
Syrer og baser Begreper
Konseptet med Arrhenius
Et av de første konseptene av syrer og baser utviklet på slutten av 1800-tallet av Svante Arrhenius, en svensk kjemiker.
Ifølge Arrhenius er syrer stoffer som i vandig oppløsning lider ionisering, slipper kun som kationer H +.
HCl (aq) → H+ (aq) + Cl- (her)
I mellomtiden er baser stoffer som lider ionisk dissosiasjon, frigjøre OH- (hydroksyl) ioner som den eneste typen anion.
NaOH (aq) → Na+ (aq) + OH- (her)
Imidlertid viste Arrhenius konsept for syrer og baser seg å være begrenset til vann.
Les også om: Arrhenius teori og Nøytraliseringsreaksjon.
Bronsted-Lowry-konseptet
Bronsted-Lowry-konseptet er bredere enn Arrhenius og ble introdusert i 1923.
I følge denne nye definisjonen er syrer stoffer som er i stand til å donere en proton H
+ til andre stoffer. Og baser er stoffer som er i stand til å akseptere et H-proton+ av andre stoffer.Det er det syre er en protondonor og basen er en protonreseptor.
Det kjennetegner en sterk syre som en som ioniserer helt i vann, det vil si frigjør H-ioner+.
Imidlertid kan stoffet være amfiprotisk, det vil si i stand til å oppføre seg som en syre eller Bronsted base. Se på eksemplet på vann (H2O), et amfiprotisk stoff:
HNO3(aq) + H2O(l) → NEI3- (aq) + H3O+(aq) = Bronsted base, aksepterte protonen
NH3(aq) + H2O(l) → NH4+(aq) + OH-(aq) = Bronsted Acid, donerte protonen
Videre oppfører stoffer seg som konjugerte par. Alle reaksjoner mellom en syre og en utgangspunkt av Bronsted involverer overføring av en proton og har to konjugerte syre-basepar. Se eksemplet:

HCO3- og CO32-; H2O og H3O+ er konjugerte syrebasepar.
Lære mer om:
- Uorganiske funksjoner
- Syrebasisindikatorer
- Titrering
Syrenomenklatur
For å definere nomenklaturen er syrer delt inn i to grupper:
- Hidracids: syrer uten oksygen;
- Oksysyrer: syrer med oksygen.
Hidracids
Nomenklaturen forekommer som følger:
syre + elementnavn + vannholdig
Eksempler:
HCl = saltsyre
HI = hydriodic acid
HF = flussyre
oksysyrer
Nomenklaturen for oksysyrer følger følgende regler:
Du standard syrer av hver familie (familiene 14, 15, 16 og 17 i det periodiske systemet) følger den generelle regelen:
syre + elementnavn + ic
Eksempler:
HClO3 = klorsyre
H2KUN4 = svovelsyre
H2CO3: karbonsyre
For de andre syrene som dannes med samme kjerneelement, navngir vi dem basert på mengden oksygen, etter følgende regel:
| Mengde oksygen, i forhold til standard syre | Nomenklatur |
|---|---|
| + 1 oksygen | Syre + per + elementnavn + ico |
| - 1 oksygen | Syre + elementnavn + bein |
| - 2 oksygener | Syre + hypo + elementnavn + bein |
Eksempler:
HClO4 (4 oksygenatomer, ett mer enn standard syre): perklorsyre;
HClO2 (2 oksygenatomer, ett mindre enn standard syre): klorsyre;
HClO (1 oksygenatom, to mindre enn standard syre): hypoklorsyre.
Du kan også være interessert i: svovelsyre
Basenomenklatur
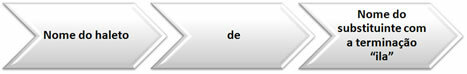
For basenomenklatur følges den generelle regelen:
Hydroksid + kationnavn
Eksempel:
NaOH = Natriumhydroksid
Men når det samme elementet danner kationer med forskjellige ladninger, blir antallet ladninger til ionet lagt til slutten av navnet, i romertall.
Eller du kan legge til suffikset -oso, til det minst ladede ionet, og suffikset -ico, til det mest ladede ionet.
Eksempel:
Jern
Tro2+ = Fe (OH)2 = Jern II hydroksid eller jernholdig hydroksid;
Tro3+ = Fe (OH)3 = Iron III hydroksid eller jernhydroksid.
Sørg for å sjekke opptakseksamensspørsmål om emnet, med kommentert oppløsning, i: Øvelser på uorganiske funksjoner.