Hybridisering av sp-type karbon2 det oppstår når den har en dobbeltbinding og to enkeltbindinger eller en pi-binding (π) og tre sigma-bindinger (σ). Faktisk sp hybridisering2 den oppstår mellom atomene som etablerer dobbeltbindingen.
Et eksempel på et slikt molekyl er formaldehyd (CH2O). Legg merke til strukturen nedenfor:
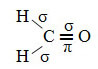
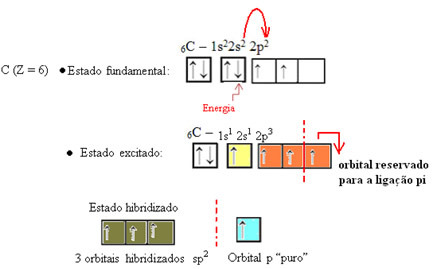
Som det fremgår av teksten "sp-type hybridisering3”, Forekommer karbonhybridisering når et elektron fra undernivå 2s mottar energi og blir“ transportert ”til 2p subnivå og stammer således fra 4 hybridiserte orbitaler fra "blandingen" av atomorbitaler ren.
Når det gjelder formaldehyd, vet vi at det vil være en pi-binding, så en av disse hybridiserte orbitalene er reservert for denne bindingen, mens de andre tre bærer sigma-bindingene:
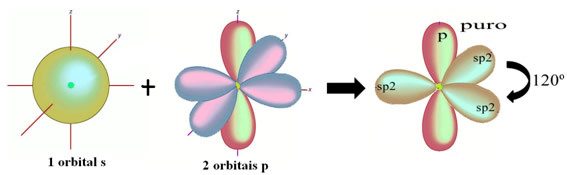
Hydrogenatomene som danner enkeltbindingen med karbon, lager den med sin bane:
De gjenværende "rene" p-orbitale dobbeltbindinger oksygenatomet og formaldehydmolekylet har følgende struktur:
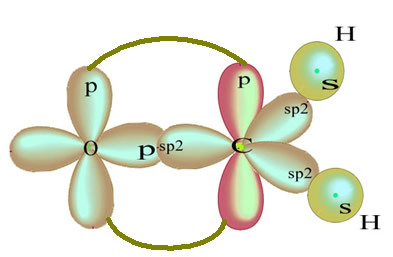
Når det gjelder typen obligasjoner som finnes i denne formaldehydstrukturen, har vi:

Tilkoblinger: 1 = 2 = σs-sp2
3 = σp-sp2
4 =πp-p
Av Jennifer Fogaça
Uteksamen i kjemi
Kilde: Brasilskolen - https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp2.htm



