Pauling-diagrammet, også kjent som energidiagrammet, er representasjon av elektronisk distribusjon gjennom kraftnivåer.
Gjennom skjemaet foreslo kjemikeren Linus Carl Pauling (1901-1994) noe utover det som allerede var kjent angående distribusjon av elektroner fra atomene til kjemiske elementer.
For å forbedre stemningen foreslo Pauling energinivåene. Gjennom dem ville det være mulig å ordne elektronene fra det laveste til det høyeste energinivået til et atom i dets grunntilstand.
Elektronisk distribusjon av Linus Pauling
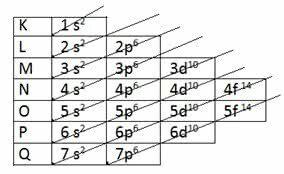
I henhold til modellen foreslått av Pauling er elektrosfæren delt inn i 7 elektroniske lag (K, L, M, N, O, P og Q) rundt atomkjernen, som hver tillater et maksimalt antall elektroner, som er henholdsvis 2, 8, 18, 32, 32,18 og 8.
På elektronikkdistribusjon de undernivåer for energi, som viser det laveste energielektronet først til det når det høyeste energilektronet.
| Elektroniske lag | Maksimalt antall elektroner | Energinivåer | ||||
|---|---|---|---|---|---|---|
| 1 | K | 2 og- | 1s2 | |||
| 2 | L | 8 og- | 2s2 | 2p6 | ||
| 3 | M | 18 og- | 3s2 | 3p6 | 3d10 | |
| 4 | N | 32 og- | 4s2 | 4p6 | 4d10 | 4f14 |
| 5 | O | 32 og- | 5s2 | 5p6 | 5d10 | 5f14 |
| 6 | P | 18 og- | 6s2 | 6p6 | 6d10 | |
| 7 | Spørsmål | 8 og- | 7s2 | 7p6 |
Lag K har bare ett undernivå (er), lag L har to undernivåer (s og p), lag m har henholdsvis tre undernivåer (s, p og d).
S undernivåer tillater opptil 2 elektroner, mens p undernivåer tillater opptil 6 elektroner. Deretter tillater d-undernivåene opptil 10 elektroner, mens f undernivåene tillater opptil 14 elektroner.
Merk at summen av elektronene som opptrer i hvert undernivå per elektronskall, resulterer i maksimalt antall elektroner i hvert av de 7 skallene.
K: s2 = 2
L og Q: s2 + s6 = 8
M og P: s2 + s6 + d10 = 18
N og O: y2 + s6 + d10 + f14= 32
Det var da Pauling oppdaget økende orden av energi:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6
Derfra vises diagonale pilene i diagrammet for å lage den elektroniske fordelingen av elementene:
 Pauling-diagram
Pauling-diagram
Eksempel på elektronisk fosforfordeling 15P:
1s2 2s2 2p6 3s2 3p3
som opptil 3 sek2 vi hadde allerede totalt 12 elektroner (2 + 2 + 6 + 2), vi trenger bare 3 elektroner til fra 3p undernivå6.
Dermed kan vi få den nødvendige mengden elektroner, så lenge den ikke er større enn 6, som er det maksimale antallet som 3p delnivå6 oppfører seg.
Les også Valencia lag og Kvantetall.
Løst øvelser om elektronisk distribusjon
Spørsmål 1
(Unirio) “Tannimplantater er tryggere i Brasil og oppfyller allerede internasjonale kvalitetsstandarder. Det store spranget i kvalitet fant sted i prosessen med å lage titanskruer og pinner, som utgjør protesene. Disse protesene er laget av titanlegeringer og brukes til å feste tannkroner, kjeveortopediske apparater og proteser, i bein i kjeve og kjeve. ” (Jornal do Brasil, oktober 1996.)
Tatt i betraktning at atomnummeret til titan er 22, vil den elektroniske konfigurasjonen være:
a) 1s2 2s2 2p6 3s2 3p3
b) 1s2 2s2 2p6 3s2 3p5
c) 1s2 2s2 2p6 3s2 3p6 4s2
d) 1s2 2s2 2p6 3s2 3p6 4s2 3d2
e) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
Riktig alternativ: d) 1s2 2s2 2p6 3s2 3p6 4s2 3d2.
Linus Pauling-diagrammet for distribusjon av elektroner i titan er:
spørsmål 2
(ACAFE) Vurderer ethvert generisk M-element, som har 1s elektronisk konfigurasjon2 2s2 2p6 3s2 3p6 4s2 3d5, kan det sies at:
JEG. dets atomnummer er 25;
II. har 7 elektroner i det siste skallet;
III. har 5 uparede elektroner;
IV. tilhører 7A-familien.
Uttalelsene er korrekte:
a) bare I, II og III
b) Bare I og III
c) Bare II og IV
d) Bare I og IV
e) Bare II, III og IV
Riktig alternativ: b) Bare I og III.
JEG. RIKTIG Når vi teller antall elektroner i den elektroniske distribusjonen ser vi at 25 ble brukt. Derfor er atomnummeret 25 og tilsvarer det kjemiske elementet mangan.
II. FEIL. Det siste laget, det vil si at det ytterste laget har 2 elektroner, som er 4-tallet2.
III. RIKTIG De uparede elektronene er i d-undernivået, som rommer opptil 10 elektroner, men i den elektroniske distribusjonen av mangan er bare 5 elektroner tilordnet undernivået.
IV. FEIL. Mangan ligger i 7B-familien og i 4. periode.
spørsmål 3
(UFSC) Antall elektroner i hvert delnivå av strontiumatomet (38Sr) i stigende rekkefølge av energi er:
a) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2
b) 1s2 2s2 2p6 3s2 3p6 4s2 4p6 3d10 5s2
c) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s2
d) 1s2 2s2 2p6 3s2 3p6 4p6 4s2 3d10 5s2
e) 1s2 2s2 2p6 3p6 3s2 4s2 4p6 3d10 5s2
Riktig alternativ: a) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2.
Linus Pauling-diagrammet for distribusjon av strontiumelektroner er:
Test din kunnskap enda mer! Løs også:
- Øvelser om elektronisk distribusjon
- Øvelser på det periodiske systemet