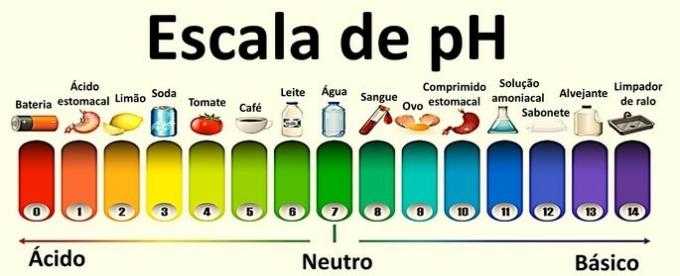
pH representerer det hydrogenioniske potensialet og pOH er det hydroksyioniske potensialet til løsningene.
Dette er logaritmiske skalaer som brukes til å måle den sure og grunnleggende karakteren til en prøve.
Verdiene som komponerer dem varierer fra 0 til 14 og ble oppnådd fra den ioniske balansen av vann.
En nøytral løsning har en pH på 7. Verdiene under 7 klassifiserer løsningene som sure, mens løsningene etter 7 er basiske.
Med pH-verdien er det mulig å finne den tilsvarende på pOH-skalaen, bare ved å gjøre en subtraksjon.
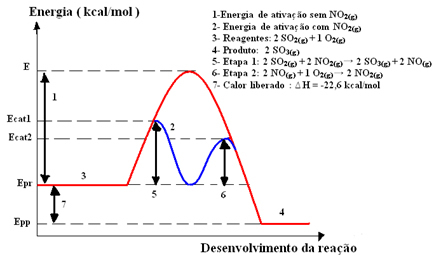
Jonisk vannbalanse
Et vannmolekyl har evnen til å ionisere i henhold til ligningen:
Her har vi en ionebalanse, fordi prosessen er reversibel og ionene kan også komme sammen og danne et vannmolekyl igjen.
En annen måte å demonstrere balansen som oppstår er gjennom autoionisering.
Et vannmolekyl genererte hydroniumioner (H3O+) og hydroksyl (OH-) gjennom forstyrrelse av et andre molekyl.
Jonisk produkt av vann (Kw)
Konstanten for den ioniske balansen mellom vann er:
Siden vann er en ren væske, blir konsentrasjonen tatt som 1 og forstyrrer ikke den konstante verdien. Derfor blir uttrykket:
O ionisk produkt av Vann é .
Dette uttrykket mottar symbolet Kw (W kommer fra det engelske ordet water - vann) og i likhet med likevektskonstanten, varierer den med temperaturen.

Bestemmelse av pH og pOH
Ved en temperatur på 25 ° C er det ioniske produktet av vann:
Ved ionisering av rent vann, 1 mol H3O+ er dannet med 1 mol OH- .
Snart,
Siden disse verdiene er ekstremt lave, ble det besluttet å bruke verdiene til cologarithms, som tilsvarer logaritmen med et byttetegn.
Påføring av cologaritme på det ioniske produktet av vann, må vi:
Vi kan observere at: hvis vi vet pH i en løsning, kan pOH-verdien bli funnet ved å trekke den første verdien fra 14.
Surhet og grunnleggende løsning
Nøytral løsning: konsentrasjonen av hydroniumioner er lik den for hydroksyler.
| [H3O+] = 1,0. 10-7 mol / L. | pH = 7 |
| [Åh-] = 1,0. 10-7 mol / L. | pOH = 7 |
Eksempel: rent vann.
syreoppløsning: konsentrasjonen av hydroniumioner er større enn den for hydroksyler.
| [H3O+] |
pH |
| [Åh-] |
pOH |
Eksempel: brus, sitron og tomat.
grunnleggende løsning: konsentrasjonen av hydroksyler er større enn hydroniumionene.
| [H3O+] |
pH |
| [Åh-] |
pOH |
Eksempel: egg, såpe og blekemiddel.
pH-beregning
Konseptet med hydrogenpotensial ble skapt av den danske kjemikeren Peter Lauritz Sorensen (1868-1939) for å uttrykke surheten i en løsning gjennom konsentrasjonen av H+.
Se tabellen nedenfor som viser ionisering av a syre:
| Innledende molaritet | 0,020 | 0 | 0 |
| ionisering | 0,001 | 0,001 | 0,001 |
| Molaritet i balanse | 0,019 | 0,001 | 0,001 |
I eksemplet har vi at konsentrasjonen av H-ioner+ é 0,001. Derfor er løsningens pH:
[H+] = 0,001 = 10-3
pH = - logg 10-3 = 3
Siden pH i løsningen er mindre enn 7, er denne løsningen sur.
Sammendrag om pH og pOH
| Definisjoner | pH: hydrogenionens potensial for løsningen. | |
|---|---|---|
| pOH: hydroksylionisk potensial i løsningen. | ||
| generell formel | pH + pOH = 14 | |
| Løsninger | Nøytral | pH = pOH = 7 |
| surt |
pH pOH> 7 |
|
| grunnleggende |
pOH pH> 7 |
|
| pH-beregning | pH = - logg [H+] | |
| Beregning av pOH | pOH = -log [OH-] |
Øvelser på pH og pOH
1. (FMTM) pH i magesaft, en vandig løsning av saltsyre (HC2), er omtrent 2. Derfor er massen, i gram, av HC2 som finnes i hver liter magesaft
Data: Molare masser (g / mol) H = 1, C2 = 35,5
a) 7,3 · 10-2
b) 3,65 · 10-1
c) 10-2
d) 2
e) 10
Riktig alternativ: b) 3,65 · 10-1.
1. trinn: beregne konsentrasjonen av H-ioner+.
Andre trinn: beregne molarmassen av HCl.
Tredje trinn: beregne massen av saltsyre i hver liter magesaft.
2. (UEMG) Flere rengjøringsprodukter har ammoniakk i konstitusjonen. Etiketten på et av disse produktene indikerer pH = 11. Dette betyr at konsentrasjonen av hydroksoniumkationer og hydroksylanioner i dette produktet er henholdsvis:
til 1. 10-3 og 1. 10-11
b) 1. 10-11 og 1. 10-7
c) 1. 10-11 og 1. 10-3
d) 1. 10-11 og 1. 10-11
Riktig alternativ: c) 1. 10-11 og 1. 10-3.
a) FEIL. Disse konsentrasjonene tilsvarer en løsning med pH = 3.
b) FEIL. Selv om konsentrasjonen av H+ indikerer at pH i løsningen er 11, konsentrasjonen av OH-ioner- er feil, som det skal være 3, siden: pOH = 14 - pH.
c) KORREKT. pH = 11 og pOH = 3, siden pH + pOH = 14.
d) FEIL. Selv om konsentrasjonen av H+ indikerer at pH i løsningen er 11, konsentrasjonen av OH-ioner- er feil, som det skal være 3, siden: pOH = 14 - pH.
a) 0,1 mol / l NaOH
b) NaCl 0,5 mol / l
c) H2KUN4 1,0 mol / l
d) 1,0 mol / L HC1
e) 0,2 mol / l KOH
Riktig alternativ: e) KOH 0,2 mol / L.
a) FEIL. Løsningen er basisk da pH er større enn 7, men den har ikke høyere pH av alternativene.
b) FEIL. NaCl er et salt ettersom det er et produkt av en sterk syre- og basereaksjon. Derfor er pH-verdien nøytral.
c) FEIL. Svovelsyre er en sterk syre, så pH er lav.
d) FEIL. Saltsyre er en sterk syre, så pH er lav.
e) KORREKT. Løsningen er basisk da pH er større enn 7.