O atomstråle av elementer er en periodisk egenskap som bestemmer radien til et atom som varierer avhengig av elementets posisjon i det periodiske systemet.
Dermed kan de øke og redusere som atomnummer (Z) av elementet som tilsvarer antall protoner som er tilstede i atomkjernen.
Oppsummert tilsvarer atomeradiusen halvparten av avstanden mellom kjernene til to nærliggende atomer, uttrykt som følger:
r = d / 2
hvorfra:
r = radius
d = intern kjerneavstand
Generelt måles atomradiusen i pikometer (pm), submultipel av måleren (1 pikometer = 10-12 m.). Merk at når referansen ikke er et atom, men et ion, er den funnet radius den ioniske radiusen.
Atomic Radius Variation
I det periodiske systemet kan veksten av atomradius sees i følgende figur:
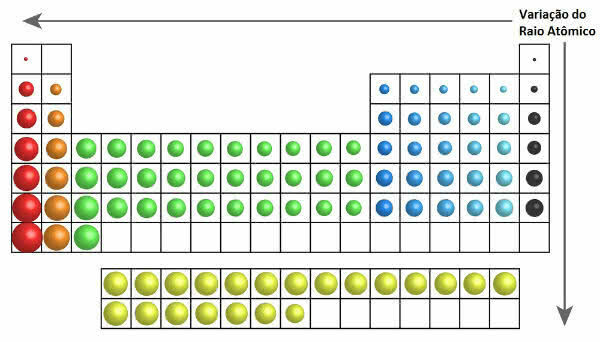 Atomic Radius Variation in the Periodic Table
Atomic Radius Variation in the Periodic Table
Dermed øker atomradien vertikalt (familier eller grupper) fra topp til bunn. På det horisontale (punktum) øker de fra høyre til venstre.
Se den omvendte variasjonen i Elektronisk tilhørighet og elektronegativitet.
Ioniseringsenergi
DE ioniseringsenergi (eller potensial) det er også en periodisk egenskap som bestemmer energien som kreves for å skifte et elektron, som uttrykkes i elektron volt (eV).
Les også: Periodiske egenskaper.
Sjekk opptakseksamen spørsmål med en kommentert oppløsning i: Øvelser på det periodiske systemet.