En nøytraliserende reaksjon oppstår når en syre reagerer med en base for å danne vann og salt. Syren gir H-ionene+ og basen gir OH-ionene- for dannelse av vann (H2O):
1 time+(her) + 1 OH-(her) → H2O(ℓ)
Denne typen reaksjon kalles "nøytralisering" fordi pH i mediet er nøytralisert. pH i vann er 7,0 (nøytral).
For at disse reaksjonene skal oppstå, er det nødvendig å frigjøre en viss mengde varme, som bare en del av energien til ioner brukes til å danne bindinger som resulterer i vannmolekyler, mens resten av energien frigjøres til ganske. Denne frigjorte energien kalles Nøytraliseringsentalpi (∆Hnøytralisering).

Siden den frigjør varme, tilsvarer den eksoterme reaksjoner, der entalpi (systemets globale energi) alltid vil være negativ, mindre enn null.
I tilfelle en reaksjon mellom sterke syrer og sterke baser, vil den nøytraliserende entalpiverdien alltid være lik - 13,8 kcal / mol eller - 57,7 kJ / mol. Dette skjer fordi basene og sterke syrer er fullstendig dissosiert i løsning og derfor er den eneste Reaksjonen som er ansvarlig for manifestasjonen av varme vil være dannelsen av vann, som vist i de tre eksemplene nedenfor:
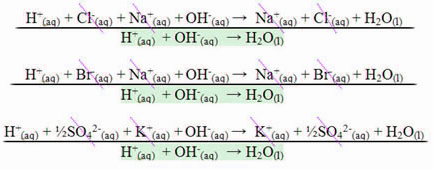
I tilfelle nøytraliseringsreaksjoner som involverer svake syrer eller baser, vil den nøytraliserende entalpiverdien være mindre enn –57,7 kJ / mol.
Av Jennifer Fogaça
Uteksamen i kjemi
Kilde: Brasilskolen - https://brasilescola.uol.com.br/quimica/entalpia-neutralizacao.htm
