Har du noen gang prøvd å vaske opp med bare vann?─ Det går ikke, ikke sant?Hvorfor kan ikke vann alene fjerne fett og smuss?At det skjer fordi sammensetningen av disse materialene er veldig forskjellig fra sammensetningen av vann, noe som gjør det vanskelig for dem å blande.
Vi sier at vannmolekyler er det polar, det vil si at de har deler som er ladet: den ene delen er positiv og den andre er negativ.Fett og oljer er apolar, noe som betyr at molekylene har ingen ladning.Dermed kan ikke de polære vannmolekylene trenge gjennom fettmolekylene og trekke dem med. Det er av samme grunn at oljen ikke blandes med vann, som vist i følgende figur:

Vann og olje blandes ikke fordi vann er polært og olje er ikke-polært
Et annet problem er at vannmolekylene danner en slags "hud" eller "film" som gjør det enda vanskeligere for det å trenge inn i smusset. Dette tynne laget kalles vannoverflatespenning. Dannelsen oppstår fordi den positive delen av et vannmolekyl tiltrekker seg den negative delen av et annet vannmolekyl, og så videre.
På denne måten er molekylene veldig tette sammen, spesielt overflatemolekylene, og danner filmen vi snakker om. Illustrasjonen nedenfor viser hvordan vannmolekyler (symbolisert med de blå kulene) tiltrekker hverandre og skaper overflatespenning:
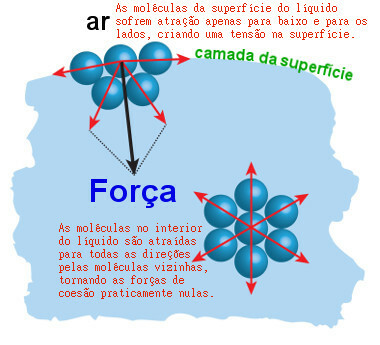
Overflatespenning er en "film" dannet av tiltrekningskreftene mellom overflatevannsmolekyler
Bevis på at vann faktisk har denne "filmen" vises på bildet nedenfor, der et insekt kan gå på toppen av vann:

Insekt på vann på grunn av intens overflatespenning
Så for å kunne rense fett og smuss, må vi bruke såpe.Men hvordan fungerer såpe? Hvordan rengjør den?
I utgangspunktet, såpen klarer å "bryte" denne "filmen" av vann, slik at den kan trenge gjennom materialene og fjerne skitt. Derfor blir såpe ofte kalt a overflateaktivt middel eller overflateaktivt middel, fordi han reduserer overflatespenningen til vannet. Det er som om såpen gjorde vannet til "våtere", vet du ?!
Men hvordan får han det?For å forstå, se på bildet nedenfor som viser strukturen til en såpe:
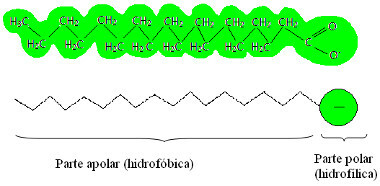
Typisk struktur for en såpe
Se at såpen har en del som er upolær (så vel som fettet og oljen)og en annen del som er polær (akkurat som vann).På denne måten samhandler den ikke-polare delen av såpemolekylet med de ikke-polære molekylene av fett og oljer,og den polare delen samhandler med de polære vannmolekylene.
Såpemolekyler fordeler seg og danner miceller, som følgende figur viser:
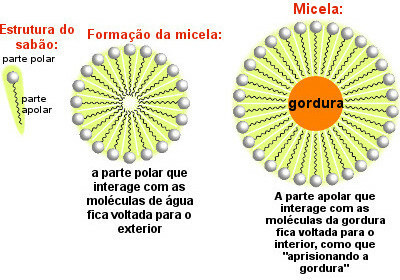
Såpemiks innpakningsfett
Merk at den ikke-polare delen av såpemolekylene omgir fettpartikkelen, som dras med av vannet som er i kontakt med den polare delen av såpen som vender utover. Dermed bidrar micellene som dannes av såpen til å fjerne fettete smuss.
Av Jennifer Fogaça
Uteksamen i kjemi



