Kovalent binding er en type interaksjon mellom atomer som har høy elektronegativitet, det vil si høy tendens til å motta elektroner. De kjemiske elementene som ofte er involvert i denne typen binding er:
Hydrogen (H)
Beryllium (Be)
Bor (B)
Karbon (C)
Nitrogen (N)
Fosfor (P)
Oksygen (O)
Svovel (S)
Fluor (F)
Klor (Cl)
Brom (br)
Jod (I)
a) Naturen til de involverte elementene
De kjemiske elementene som har høy elektronegativitet og som følgelig utfører kovalente bindinger er:
Hydrogen
Ametaler
b) Forekomst av kovalent binding
Avhengig av arten til de kjemiske elementene som er involvert i den kovalente bindingen, kan det forekomme som følger:
Mellom to hydrogenatomer;
Mellom et ikke-metallisk atom og hydrogen;
Mellom atomer av samme kjemiske element (ikke-metallisk);
Mellom atomer med forskjellige kjemiske elementer (begge ikke-metaller).
c) Antall elektroner hvert atom må motta
Antallet elektroner som hvert ikke-metallisk eller hydrogenatom mottar i en binding er relatert til oktettregel.
I følge oktetregelen er et atom stabilt når det anskaffer åtte eller to elektroner (bare i tilfelle av hydrogen) i valensskallet. Hvis et atom har for eksempel fem elektroner i valensskallet, må det motta tre elektroner for å oppnå stabilitet.
MERK: Beryllium og Boron er det unntak fra oktettregelennår de blir stabile med henholdsvis 4 og 6 elektroner i valensskallet.
Antallet elektroner i valensskallet kan enkelt bestemmes ved å analysere den kjemiske elementfamilien. I tabellen nedenfor har vi antall elektroner i valensskallet som refererer til familien som elementet tilhører, og antall elektroner det trenger å motta for å oppnå stabilitet:

d) Kovalent bindingsprinsipp
Som i den kovalente bindingen, har alle involverte atomer en tendens til å motta elektroner, obligatorisk, det vil være en deling av elektronene som er tilstede i valensskallet (nivået lengst fra kjernen).
Deling skjer når et elektron fra valensskallet til et atom blir en del av den samme elektroniske skyen som omgir et annet elektron fra valensskallet til et annet atom.
Hvert hydrogenatom har for eksempel et elektron i valensskallet. Når to elektroner blir en del av den samme skyen, begynner hvert hydrogen å ha to valenselektroner, det vil si at det stabiliserer seg.
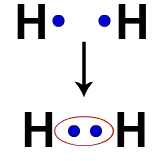
Elektroner med to hydrogenatomer som opptar samme elektronsky
e) Formler brukt i kovalent binding
1ª) molekylær formel
Det er en indikasjon på antall atomer i hvert element som danner molekylet som stammer fra kovalente bindinger.
Eksempel: H2O
I vannmolekylet har vi 2 hydrogenatomer og 1 oksygenatom.
2ª) strukturformel
Strukturformelen er demonstrasjonen av organisasjonen av molekylet, det vil si at den demonstrerer båndene mellom atomer. For dette brukes bindestreker som representerer bindingen til hvert atom:
Enkelt (?): Indikerer at atomet bare delte ett elektron fra valensskallet med et annet atom og omvendt;
Dobbelt (?): Indikerer at atomet delte to elektroner fra valensskallet med det andre atomet og omvendt;
Trippel (≡): Indikerer at atomet har delt tre elektroner fra valensskallet med et annet atom og omvendt.
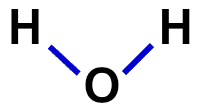
Strukturell formel for vann
3ª) Lewis 'elektroniske formel
Lewis elektroniske formel representerer også organisasjonen av molekylet (elektronisk formel), men den tar sikte på å demonstrere deling av elektroner i atomer.
For å bygge den er det nok å respektere organisasjonen som er foreslått i en strukturformel og erstatte hvert spor av bindingene (enkelt, dobbelt eller tredobbelt) med "to kuler", som representerer elektronene.
I strukturformelen for vann har vi for eksempel to enkle bindinger mellom hydrogener og oksygen. Dermed vil vi bare ha to baller, avgrenset av en ellipse (som representerer den elektroniske skyen).
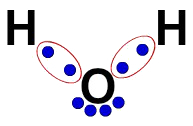
Lewis 'elektroniske formel for vann
Av meg. Diogo Lopes Dias
Kilde: Brasilskolen - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-ligacao-covalente.htm

