Hydrokarboner, også kalt hydrogenkarbider, er organiske forbindelser hvis sammensetning bare har atomer på karbon (C) og fra hydrogen (H), og har således den generelle formel CxHy.
Et hydrokarbon består av en karbonstruktur som hydrogenatomer binder seg inn i kovalent binding.
Det er den viktigste forbindelsen i organisk kjemi.
Alle typer hydrokarboner oksiderer lett og frigjør dermed varme. De fleste av dem er ikke vannløselige.
Naturlige hydrokarboner er kjemiske forbindelser dannet på jorden (mer enn 150 km fra dybde) ved høyt trykk og nå soner med lavere trykk gjennom geologiske prosesser.
Hvor finnes hydrokarboner?
Hovedkilden til hydrokarbon er olje. På grunn av dette er hydrokarbonet til stede i flere derivater som parafin, parafin, naturgass, Bensin, Vaselin, diesel olje, LPG (Flytende petroleumsgass), polymerer (som plast og gummi), blant andre.
Denne organiske forbindelsen utgjør 48% av Brasils energimatrise.
Karbonkjeden som utgjør en del av sammensetningen av et hydrokarbon er tetravalent, det vil si at den kan lage fire forbindelser.
Karbon er i stand til å binde seg med andre karbonatomer og med hydrogen gjennom enkle lenker, dobler eller tredobler.
Klassifisering av hydrokarboner
Klassifiseringen av hydrokarboner er basert på tre spesifisiteter: a skjema av den viktigste karbonkjeden, den Tilkoblinger av karbonkjedene, den tilstedeværelse av alkylradikaler i karbonkjeden og tilstedeværelse av heteroatomer dele karbonkjeden.
vite mer om hydrogen.
Hoved karbonkjede form
Når det gjelder formen på den viktigste karbonkjeden, er klassifiseringen av hydrokarboner delt inn i alifatisk og syklisk.
Sjekk ut hva hver av disse formene for karbonkjede består av.
alifatiske hydrokarboner
Alifatiske hydrokarboner dannes av karbonkjeder åpen eller asyklisk. I disse kjedene er karbon terminaler.
Eksempler:
alkan
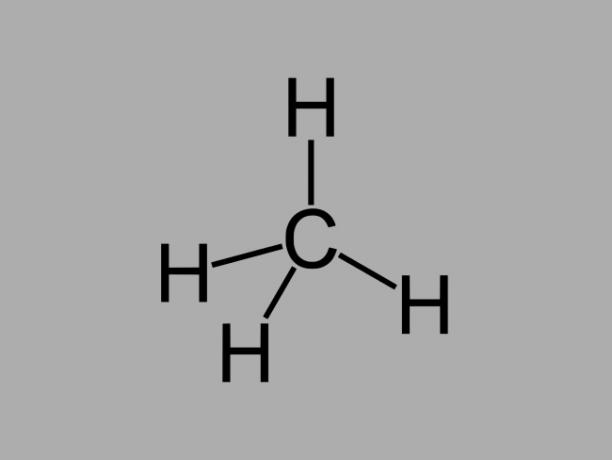
Alkan hydrokarboner, også kalt parafiner eller parafinisker oljeaktige forbindelser der det bare er enkeltbindinger mellom karbon.
Den generelle formelen for et alkan er CNeiH2Nei + 2 (n = hvilket som helst heltall).
alken
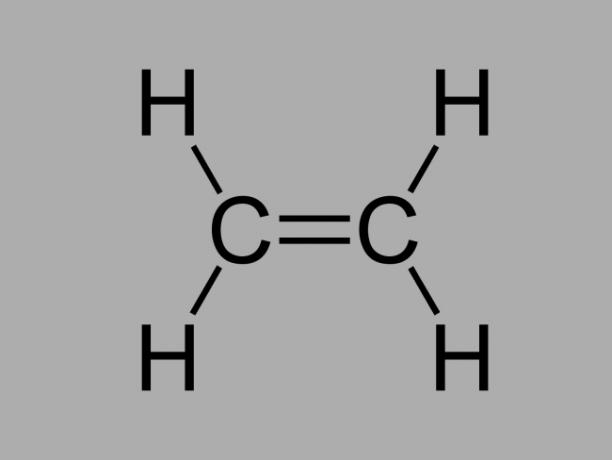
Også kalt olefin, alken eller etylen hydrokarbonalken er en dårlig reaktiv forbindelse hvor det er en dobbeltbinding mellom karbonene.
Den generelle formelen for et alken er CNeiH2Nei.
alkyne
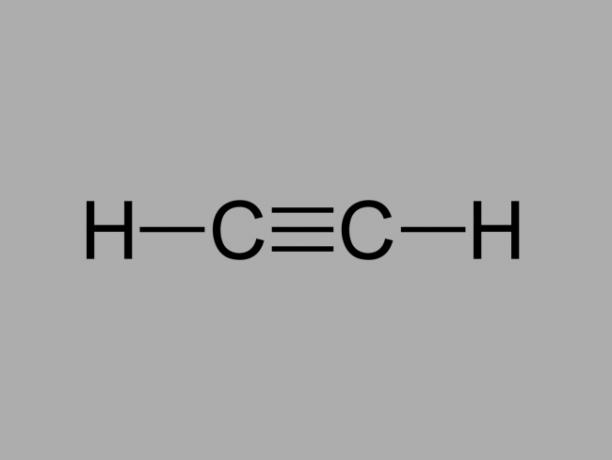
Også kalt metylacetylen, alkyne er et hydrokarbon der de eksisterende bindingene mellom karbon er tredobbelt.
Den generelle formelen for en alkyn er CNeiH2Nei-2.
alkadien

Også kalt diener eller diolefiner, alkadiene er hydrokarboner der bindingen mellom karbonene er dobbelt.
Den generelle formelen for en alkadien er CNeiH2Nei-2.
Sykliske hydrokarboner
Sykliske hydrokarboner dannes av lukkede eller sykliske karbonkjeder. Disse kjedene har ikke terminalkarboner.
Eksempler:
Cyclan
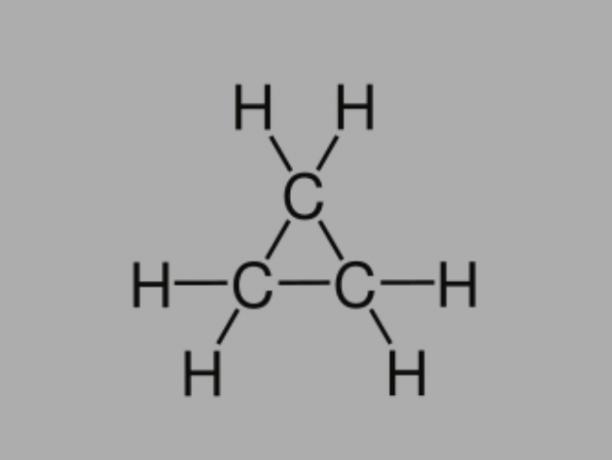
Også kalt cykloalkan, cykloparaffin eller naftenisk hydrokarbon, syklan er et mettet hydrokarbon, sammensatt av enkeltbindinger.
Den har en lukket karbonkjede og dens generelle formel er CNeiH2Nei.
Syklonisk

Også kalt sykloalkenerer sykluser umettede hydrokarboner, sammensatt av dobbeltbindinger.
En cyklene har en lukket karbonkjede og dens generelle formel er CNeiH2Nei−2.
syklist
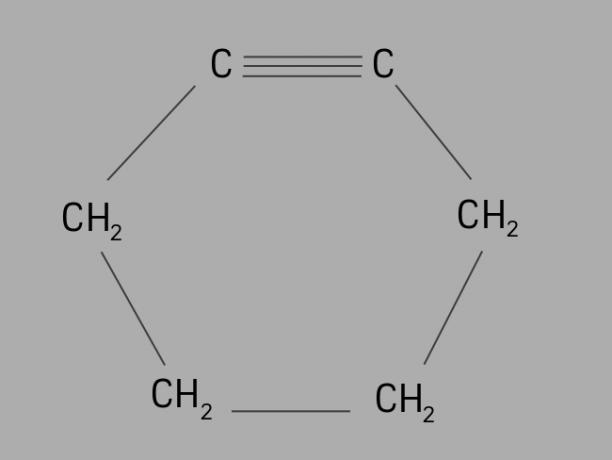
Også kalt cycloalkyne eller cycloalkyneer syklin et syklisk og umettet hydrokarbon.
Den er dannet av en lukket karbonkjede, med trippelbindinger, og dens generelle formel er CNeiH2Nei-4.
Aromatisk

eller

Også kalt arenaer, aromatiske hydrokarboner er umettede forbindelser dannet av dobbeltbindinger.
En aromatisk har en lukket eller syklisk karbonkjede, og dens generelle formel er C6H6.
Type binding av karbonkjeder
Avhengig av typen kobling av karbonkjedene, kan hydrokarboner klassifiseres i mettet eller umettet.
Se nedenfor hva hver av disse klassifiseringene består av.
Mettede hydrokarboner
Mettede hydrokarboner dannes av enkle lenker.
Eksempler: alkaner, syklaner.
umettede hydrokarboner
Umettede hydrokarboner dannes av dobbeltbindinger eller tredobler.
Eksempler: alkener, alkyner, alkadiene.
Tilstedeværelse av alkylradikaler
Når det gjelder tilstedeværelsen av alkylradikaler, kan hydrokarboner ha en karbonkjede vanlig eller forgrenet.
normal karbonkjede
Et vanlig karbonkjede hydrokarbon har ikke alkylradikaler.
Eksempel: pentan
forgrenet karbonkjede
Når et hydrokarbon har en forgrenet karbonkjede, betyr det at dets viktigste karbonkjede har alkylradikaler.
Eksempel: metylpropan
Tilstedeværelse av heteroatomer som deler karbonkjeden
Den sekvensielle karbonkjeden kan eller ikke deles avhengig av tilstedeværelsen av heteroatomer.
Homogen karbonkjede
Når et hydrokarbon har en homogen hovedkarbonkjede, betyr det at denne kjeden er ikke delt av heteroatomer.
Heterogen karbonkjede
Hvis et hydrokarbon har en heterogen hovedkarbonkjede, hadde denne kjeden sin delt karbonkjede av et heteroatom.
Nomenklatur for hydrokarboner
Nomenklaturen for hydrokarboner er definert gjennom en kombinasjon av tre deler:

Prefikset identifiserer mengden karbon, mellomproduktet identifiserer typen binding, og suffikset indikerer funksjonen som forbindelsen tilhører (i dette tilfellet hydrokarboklassen).
Se nedenfor for listen over prefikser og mellomprodukter som kombineres for å betegne hydrokarboner.
Prefiksliste
| Antall karbonatomer | Prefiks |
|---|---|
| 1 | Møtte- |
| 2 | Et- |
| 3 | Rekvisitt- |
| 4 | Men- |
| 5 | pent- |
| 6 | Hex- |
| 7 | Hept- |
| 8 | Okt- |
| 9 | Ikke- |
| 10 | Des- |
Mellommenneliste
| Tilkoblingstype | Mellommann |
|---|---|
| Bare enkeltsamtaler | -an- |
| Par | -en- |
| trippel | -i- |
| to par | -dien- |
Se på noen eksempler på navngivning av hydrokarbon.
Eksempler:
CH3 - CH2 - CH2 - CH3
I strukturformen ovenfor kan vi se en 4-karbonforbindelse som bare har enkeltbindinger (indikert med symbolet "-").
- Prefiks for 4 karbon = but-
- Mellomliggende for enkeltbindinger = -an-
- Suffiks av hydrokarbon = -o
Se at foreningen av prefiks + mellomliggende + suffiks gir opphav til navnet BUTANE.
CH2 = CH2
Den strukturelle formen ovenfor har 2 karbonatomer og 1 dobbeltbinding (indikert med “=” symbolet).
- Prefiks for 2 karbon = et-
- Mellomliggende for dobbeltbindinger = -en-
- Suffiks av hydrokarbon = -o
Se at foreningen av prefiks + mellomliggende + suffiks gir opphav til navnet ETHENE.
CH2 = CH - CH2 - CH3
CH3 - CH = CH2 - CH3
Merk at begge de ovennevnte strukturformene har 4 karbonatomer og 1 dobbeltbinding (indikert med "=" symbolet).
Dermed har vi:
- Prefiks for 4 karbon = but-
- Mellomliggende for dobbeltbindinger = -en-
- Suffiks av hydrokarbon = -o
Se at foreningen av prefiks + mellomliggende + suffiks ville gi opphav til navnet BUTENE for de to strukturformene.
Vær imidlertid oppmerksom på at strukturformene ikke er identiske, så nomenklaturene kan heller ikke være det.
Forskjellen mellom de to strukturformene ligger i plasseringen av dobbeltbindingen.
I dette tilfellet må vi nummerere karbonene i kjeden fra enden nærmest dobbelten. Derfor må vi nummerere fra venstre til høyre i de aktuelle sakene.
I CH2 = CH - CH2 - CH3:
- CH2 blir 1
- CH blir 2
- CH2 blir 3
- CH3 blir 4
Merk at dobbeltbinding er mellom karbon 1 det er karbon 2.
Vi må bruke det minste tallet (1) for å finne dobbeltbindingen: BUTENE -1
I CH3 - CH = CH2 - CH3:
- CH3 blir 1
- CH blir 2
- CH2 blir 3
- CH3 blir 4
Merk at dobbeltbindingen er mellom karbon 2 det er karbon 3.
Vi må bruke det minste tallet (2) for å finne dobbeltbindingen: BUTENE -2
I følge IUPAC (International Union of Pure and Applied Chemistry - International Union of Pure and Applied Chemistry), plasseringen skal angis litt før å være lokalisert (når det gjelder strukturformalene ovenfor, dobbeltbindingen, representert av mellomproduktet “-En-”).
Med det har vi en andre måte, som for øvrig er den mest korrekte, å skrive nomenklaturen til de tilgjengelige strukturformene.
CH2 = CH - CH2 - CH3: BUTENE -1 eller BUT-1-ENO (mer riktig form)
CH3 - CH = CH2 - CH3: BUTENE -2 eller BUT-2-ENE (mer riktig form)
Lære mer om IUPAC og nomenklatur.