Organiske forbindelser er molekylære, det vil si atomer deres bærer kovalente bindinger med hverandre. Når vi analyserer båndene mellom karbon, som kan være enkle, doble eller tredoble, observerer vi at de er ikke-polære bindinger, da det ikke er noen forskjell i elektronegativitet mellom atomene, ettersom de tilhører det samme element.
Videre, siden hydrogen og karbon har en veldig liten elektronegativitetsforskjell, er bindingene mellom dem også ikke-polare.
Ikke-polære forbindelser:
Med det kan vi konkludere med at Hydrokarboner (organiske forbindelser som bare har karbon- og hydrogenatomer) er ikke-polare molekyler. I disse forbindelsene er den intermolekylære interaksjonen av den induserte dipol-typen, som er den svakeste som eksisterer.
Siden de er svake, er disse interaksjonene enkle å bryte. På grunn av dette, kokepunktet og smeltetemperaturen for hydrokarboner er lavere enn for andre funksjoner.

Sammenligning av hydrokarboner, kokepunkter vil øke når molær masse også øker.
For eksempel er etan og butan begge alkaner. Se kokepunktene til hver bestemt eksperimentelt:
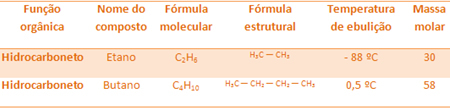
Vær oppmerksom på at koketemperaturen til butan er mye høyere enn etanens, siden molarmassen også er høyere.
Nå når vi sammenligner hydrokarboner som har samme molare masse (de er isomerer), men som har forskjellige typer karbonkjeder, innser vi at jo større antall grener, desto lavere koketemperaturfordi strukturen til molekylet blir mer kompakt, det vil si at overflaten minker.
Ikke stopp nå... Det er mer etter annonseringen;)
Alle alkaner nedenfor har samme molekylformel, C5H12, men koketemperaturene deres er forskjellige:
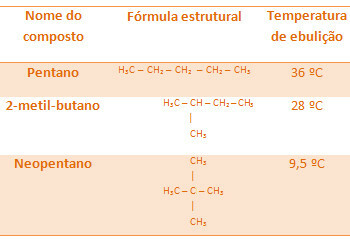
Vær oppmerksom på at neopentans koketemperatur er lavest ettersom den har flere grener.
Vi kan vurdere at de andre organiske funksjonene er avledet fra hydrokarboner, gjennom erstatning av ett eller flere hydrogener med atomer eller grupper av atomer av andre grunnstoffer. Generelt har de andre organiske funksjonene oksygen eller nitrogen, som er mer elektronegative grunnstoffer enn karbon. De tiltrekker seg sterkere paret elektroner som deles med karbon, og gjør derfor molekylet polært:
Polarforbindelser:
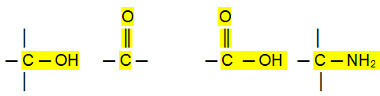
Aldehyder, ketoner og organiske halogenider har høyere kokepunkter enn hydrokarboner, fordi deres intermolekylære interaksjon er den permanente dipolen, som er sterkere enn den for indusert dipol.
Alkoholer, karboksylsyrer og aminer har derimot enda høyere koketemperaturer, ettersom de utfører hydrogenbindinger, den mest intense typen intermolekylær interaksjon.
For forbindelser med alle disse funksjonene gjelder det samme som vi så for hydrokarboner:

Av Jennifer Fogaça
Uteksamen i kjemi
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
FOGAÇA, Jennifer Rocha Vargas. "Polaritet og koketemperatur for organiske forbindelser"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/polaridade-temperatura-ebulicao-dos-compostos-organicos.htm. Tilgang 28. juni 2021.