DE ioniseringskonstant gir Vann(Kw), O hydrogenpotensial(pH) det er hydroksylionisk potensial (pOH) de er målinger viktig for beregninger som involverer kjemisk balanse i sure og basiske løsninger, samt ved å bestemme konsentrasjonen av H-ioner+ og oh- av de aktuelle løsningene.
Hva er Kw?
Det ioniske produktet av vann, eller Kw (dette wmidler vann - vann, på engelsk), er konstanten som brukes til å representere balanse generert av selvionisering av vann. Selv med en veldig liten hastighet ioniserer vann som produserer H-ioner+ og oh-, i henhold til følgende kjemiske ligning:
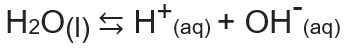
Når vi analyserer ligningen, innser vi at når ionisering fra et molekyl med rent vann genereres et H-ion.+ og et OH-ion-, det er det konsentrasjonen av disse ionene vil alltid være den samme. Selv når det er en økning i temperaturen, som forårsaker en økning i ioniseringshastigheten, forblir konsentrasjonene de samme.
Les også:Ioniseringsenergi
Ikke stopp nå... Det er mer etter annonseringen;)
Basert på eksperimentelle målinger ble konsentrasjonen av H-ioner beregnet
+ og oh- (som følge av selvionisering av vann) ved 25 ° C og verdien av 1. 10-7 mol / L.. Det er, av totalt 1 milliard vannmolekyler, kun to gjennomgår ionisering. Dette viser at rent vann har en lav grad av ionisering og forklarer det veldig lave Elektrisk ledningsevne av rent vann.Tatt i betraktning det som ble vist ovenfor, kan vi skrive uttrykk av vannbalansekonstanten:

Bruk av ionekonsentrasjonsverdier+ og oh- Ved 25 ° C kan vi beregne verdien av Kw:
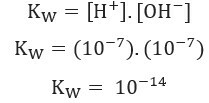
Som nevnt tidligere, denne verdien av Kw endres med økende temperatur, som vist i tabellen nedenfor:
T (° C) |
Kw |
10 |
0,29. 10-14 |
20 |
0,68. 10-14 |
25 |
1,00. 10-14 |
30 |
1,47. 10-14 |
40 |
2,92. 10-14 |
60 |
9,40. 10-14 |
For å lære mer om dette emnet, les teksten vår: Jonisk vannprodukt.
Hva er pH og pOH?

akronymet pH midler hydrogenpotensial og ble opprettet av den danske biokjemikeren Soren Sorensen, i 1909, for å legge til rette for arbeidet med konsentrasjoner av hydrogenioner [H+], som vanligvis uttrykkes i desimaltall. For å lære mer om dette emnet, les teksten vår: Hva er pH?
Denne typen notasjon indikerer H ion-innholdet+ til stede i løsningen og er definert av det matematiske uttrykket:
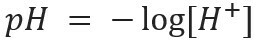
På samme måte kan vi definere pOH eller hydroksylionisk potensial, som forteller oss OH-ioninnhold- til stede i løsningen. Dens matematiske uttrykk er:
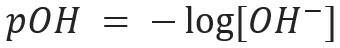
I en vandig løsning vil det alltid være H-ioner+ og oh- (på grunn av ionisering av vann) som vil bli brukt til å karakterisere en løsning i surt eller grunnleggende. Jo flere H-ioner+ det er i løsningen, jo surere blir den. Følgelig tilstedeværelsen av OH-ioner- i løsningen vil gjøre det mer grunnleggende. Hvis det er en likevekt i mengden av disse ionene, blir løsningen klassifisert som nøytral.
pH-skala
PH-skalaen vises med verdier fra 0 til 14 (verdier målt ved 25 ° C). Se pH-skalaen i bildet nedenfor:

Jo lavere pHav løsningen,større er dens surhet og jo nærmere slutten av skalaen, det vil si nærmere 14, jo større blir dens grunnleggende karakter. For eksempel har sitronsaft en pH på 2, mens blekemidler har en pH på 12.
Hvordan beregne pH og pOH
å vite ionekonsentrasjon, vi kan beregne verdiene av pH og pOH av løsningene, og når vi vet potensielle verdier, beregner vi konsentrasjon av ioner i løsninger. For dette formålet brukes følgende uttrykk:
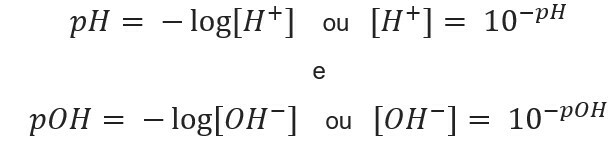
La oss gå til eksemplene:
Eksempel 1
Hvis vi vil vite pH i en løsning med [H+] = 0,001 mol / l, bruk bare formelen som ble presentert tidligere:
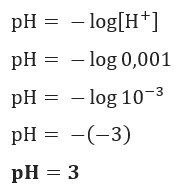
Eksempel 2
Nå, for å finne ut hva som er konsentrasjonen av OH- av en løsning med pOH = 5, bare erstatt verdien i følgende formel:

Hvis vi bruker samme potensialskala for den ioniske balansen mellom vann, vil vi ha:
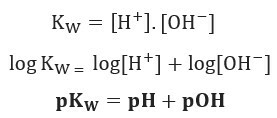
Som nevnt, ved 25 ° C, Kw = 10-14. Derfor:

Med dette kan vi beregne pOH for en løsning basert på pH. Hvis vi har en løsning med en pH på 3, vil pOH-verdien være 11.
Vite mer: Nøytrale, sure og basiske medier
løste øvelser
Spørsmål 1 (UEFS-BA) Konsentrasjonen av OH-ioner–(her) i en gitt ammoniumhydroksydoppløsning, ved 25 ° C, er lik 1,10–3 mol / L. POH for denne løsningen er:
a) 0
b) 1
c) 3
d) 11
e) 13
Vedtak: Bokstav C. Hvis vi har [OH–] = 10–3 mol / L, så din POH vil være lik 3.
Se:
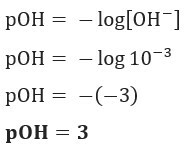
Spørsmål 2 (UEA-AM) Vurder følgende informasjon, hentet fra et mineralvannmerke i byen Porto Seguro (BA):
nitrat 1,45 mg / l
pH ved 25 ° C 4,51
Dette mineralvannet er
a) sur og har [H+] –].
b) sur og har [H+]> [OH–].
c) nøytral og har [H+] = [OH–].
d) grunnleggende og har [H+]> [OH–].
e) grunnleggende og har [H+] –].
Vedtak: Bokstav B. Ettersom pH-verdien til mineralvann som er oppgitt på etiketten er mindre enn 7, kan vi si at det er en sur løsning og derfor konsentrasjonen av H-ioner+ er større enn OH-.
Spørsmål 3 (UEA-AM) En måte å raskt produsere gassformig hydrogen i laboratoriet er ved å reagere pulverisert metallisk sink med saltsyre (HCl), i en konsentrasjon på 1,0 mol / L:
Zn (s) + 2 HC1 (aq) → ZnCl2 (aq) + H2 (g)
Tatt i betraktning at saltsyren er 100% ionisert og at løsningen er ved 25 ° C, er det riktig å si at pH i saltsyreoppløsningen nevnt i teksten er
- 0
- 1
- 3
- 13
- 14
Vedtak:Bokstaven A. Vi kan beregne pH i løsningen ved hjelp av konsentrasjonen av HCl informert i teksten, siden konsentrasjonen av [H er 100% ionisert.+] vil være den samme, for hvert ioniserte HCl-molekyl, ett H-ion+ vil bli generert. Derfor:
Av Victor Ferreira
Kjemilærer