Koketemperaturen i organiske forbindelser er påvirket av to faktorer: typen intermolekylær interaksjon og størrelsen på molekylet.
Jo større molekylets størrelse er, desto høyere er koketemperaturen.
Observer strukturene og deres respektive T.E .: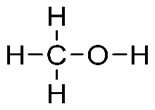 DU. (° C): 64,5
DU. (° C): 64,5
Metanol
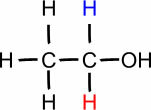 DU. (° C): 78,3
DU. (° C): 78,3
Etanol
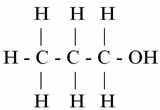 DU. (° C): 97,2
DU. (° C): 97,2
Propanol
Merk at når molekylet øker antall karbon, blir kokepunktet høyere. Dermed koker metanol som bare har ett karbonatom ved 64,5 ° C og Propanol (3 karbon) når bare sin T.E. ved 97,2 ° C.
Men i molekyler av samme størrelse? Hvordan vite hvilken som har T.E. høyere?
Type intermolekylær interaksjon vil avgjøre.
Eksempel: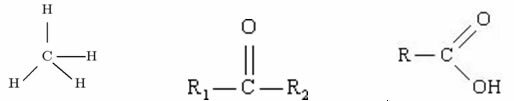
Metanketon karboksylsyre
Blant disse tre organiske strukturene, hvilken har den høyeste T.E.?
I dette tilfellet kan vi ikke stole på størrelsen på molekylet som vi gjorde før, da de tre strukturene ikke skiller seg ut i denne forbindelse.
Regelen som nå gjelder er: Jo større intensiteten til de intermolekylære kreftene er, desto høyere blir koketemperaturen.
Indusert dipol
Stigende intensitetsrekkefølge →
Basert på denne intensitetsskalaen, se hvilke krefter som dominerer i molekylene til:
Metan: dipolindusert
Keton: dipol-dipol
Karboksylsyre: hydrogenbindinger
Med dette kan vi klassifisere hvilke av disse molekylene som har den høyeste koketemperaturen: syren karboksylsyre har høyere T.E. fordi hydrogenbindingen i denne forbindelsen har størst intensitet.
Metan
Stigende intensitetsrekkefølge →
Denne ordningen viser at metan har det laveste kokepunktet på grunn av den dominerende typen intermolekylær kraft (indusert dipol).
Av Líria Alves
Uteksamen i kjemi
Brasil skolelag
Ikke stopp nå... Det er mer etter annonseringen;)
Se mer!
Polariteten til organiske forbindelser
Organisk kjemi - Kjemi - Brasilskolen
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
SOUZA, Líria Alves de. "Koketemperatur for organiske forbindelser"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/temperatura-ebulicao-dos-compostos-organicos.htm. Tilgang 28. juni 2021.


