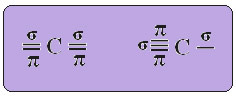
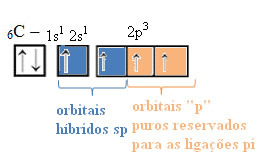
DE sp-type karbonhybridisering det skjer bare når det lager to pi-bindinger (π) og to sigma-bindinger (σ). I dette tilfellet er det altså to muligheter: karbon kan lage to dobbeltbindinger eller en enkel og en tredobling, som vist nedenfor:
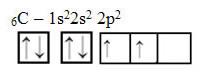
Teksten "sp-type hybridisering3”Viser i detalj hvordan karbonhybridisering foregår. Husk: hybridisering er "blanding" av rene atomorbitaler, som stammer fra hybridatomorbitaler som tilsvarer hverandre, men er forskjellige fra de opprinnelige rene orbitaler. Så dette skjer i karbonorbitalene som opprinnelig ble representert slik:
Imidlertid, med mottak av energi, fremmes et elektron (representert med en pil) fra 2s-banen til 2p-banen:
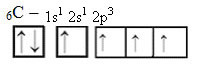
På denne måten har karbonet fire ikke-parrede orbitaler, som er i stand til å lage fire kovalente bindinger, ikke bare to.
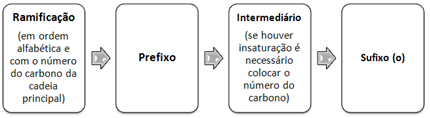
I tilfelle av hybridisering av sp-typen vet vi at to obligasjoner vil være pi; disse forekommer i de rene “p” orbitalene, mens de to andre orbitalene, som er sp-hybrider, vil utgjøre de gjenværende sigma-bindingene.
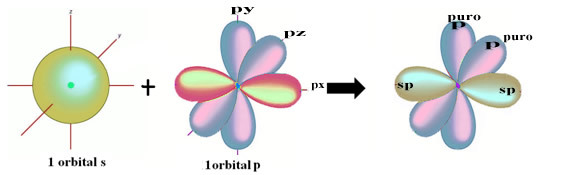
Den romlige representasjonen av denne hybridiseringen mellom en s og en p-bane, som gir opphav til en hybrid sp-bane, kan vises som følger:
Ikke stopp nå... Det er mer etter annonseringen;)
I figuren over er det veldig klart at det er to rene orbitaler som vil gjøre pi-bindinger.
For at du skal forstå hvordan dette skjer, la oss ta et eksempel på et molekyl cyanidgass (HCN), brukt i USA i gasskamre for fanger dømt til dødsstraff. Dens strukturformel er gitt av:
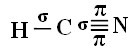
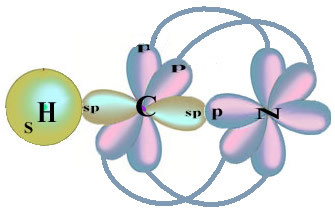
Når det gjelder karbon, har dets atomorbitaler allerede blitt vist, se nå på hydrogen- og nitrogenorbitalene:
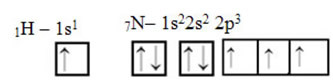
Vær oppmerksom på at den uparrede hydrogenbanen som vil utføre sigma-bindingen er "s", som er romlig representert av en sirkel; og nitrogenorbitaler er av "p" -typen, representert med tre doble ovoider (hver i et romlig felt: x, y, z). Dermed er strukturen til HCN-molekylet representert som følger:
Når det gjelder typen obligasjoner som finnes i denne formaldehydstrukturen, har vi:
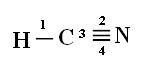
Tilkoblinger: 1 = σs-sp
2 = σp-sp
3 = 4 = πp-p
Av Jennifer Fogaça
Uteksamen i kjemi
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
FOGAÇA, Jennifer Rocha Vargas. "Sp-type hybridisering"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp.htm. Tilgang 28. juni 2021.