Volumetrisk analyse eller volumetri det er en laboratorieprosedyre der vi bruker et visst volum av a løsning i konsentrasjon kjent for å bestemme konsentrasjonen av en annen løsning. Volumet av løsningen med kjent konsentrasjon vil bli bestemt når den reagerer fullstendig med løsningen av ukjent konsentrasjon, det vil si at de involverte løsningene må reagere med hverandre.
Instrumentene som mest brukes til å måle et gitt volum er:
- Pipetter

Eksempel på pipette brukt i volummåling
- Burette

Buretten er et viktig volumetrisk måleutstyr
Volummålingen gjøres ved å evaluere høyden på den såkalte menisken, som ikke er noe annet enn væskeens overflateområde, som har et rektangulært eller kupplet aspekt (dråpeform), avhengig av beholderens tykkelse. Jo bredere beholderen er, desto mer rektangulær er menisken; jo tynnere beholderen, jo mer konveks blir den. For å vurdere menisken, må øyet være nøyaktig i høyden, og vi må bruke det nedre området som referanse, hvis menisken er rektangulær, eller spissen hvis den er bulet. Se en fremstilling av en vurdering:
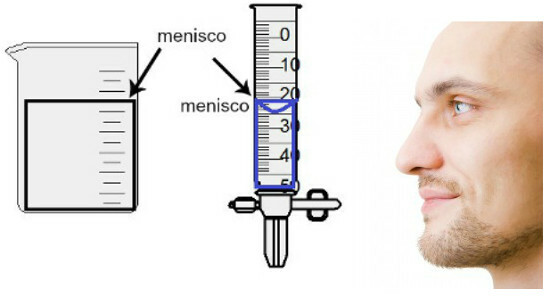
For å vurdere en menisk er det viktig at øynene dine ser mot den.
I volumetrisk analyse er det mest brukte utstyret buretten. Dette er fordi, siden metoden innebærer kjemiske reaksjoner og disse kan behandles raskt, tillater buretten væsken frigjøres i dråper på spissen, noe som gjør det mulig for oss å stoppe væsken fra å komme ut mer kontrollert.
En av de mest brukte prosedyrene innen volumetri er titrering. Det er en volumetrisk analyse som involverer forekomsten av en reaksjon mellom en syre og en base eller omvendt. Utstyret som kreves for realisering er representert i bildet nedenfor:
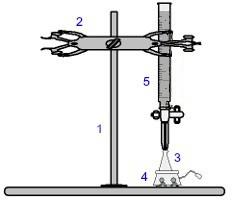
Representasjon av utstyret som brukes i en titrering
Tallene i blått betyr:
1) Universell støtte;
2) Klør (brukes til å holde buretten);
3) Erlenmeyer (mottar løsningen av ukjent konsentrasjon);
4) Magnetomrører (brukes til å røre løsningen som er tilstede i Erlenmeyer-kolben);
Ikke stopp nå... Det er mer etter annonseringen;)
5) Burette (mottar løsningen med kjent konsentrasjon).
Et volum av løsningen med ukjent konsentrasjon med fenolftaleinindikatoren tilsettes erlenmeyer-kolben (umiddelbart blir løsningen rosa). I buretten plasseres et visst volum av løsningen med kjent konsentrasjon. Deretter dryppes syreoppløsningen fra buretten direkte i den grunnleggende løsningen i Erlenmeyer-kolben. Dette dryppet varer til basisløsningen blir fargeløs, på hvilket punkt vi kaller vendepunktet, noe som indikerer at all basen som er tilstede i løsningen har reagert fullstendig med syren.
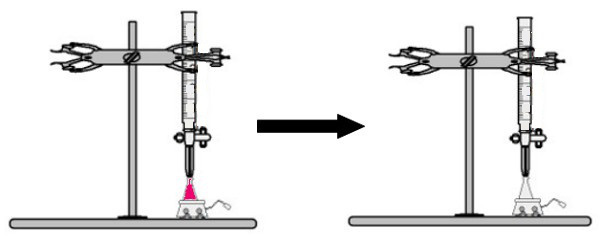
Ved vendepunktet er løsningen ikke lenger rosa og blir fargeløs
Observasjon: Hvis løsningen med ukjent konsentrasjon er sur, når den mottar fenolftaleinindikatoren, vil den være fargeløs. Dermed blir vendepunktet i titreringen når den sure oppløsningen blir rosa når den mottar den grunnleggende løsningen fra buretten.
Til slutt, for å bestemme konsentrasjonen av den grunnleggende løsningen, bruk bare følgende ligning:
Ma.Va = Mb.Vb
Ma = sur molaritet;
Va = syrevolum;
Mb = grunnmolaritet;
Vb = basisvolum.
Følg nå et eksempel på hvordan beregningen av en løsning med ukjent molaritet utføres.
1.) 30 ml av en ukjent baseløsning ble tilsatt en Erlenmeyer-kolbe for å utføre en titrering for å bestemme konsentrasjonen (molaritet). I buretten ble det tilsatt 50 ml av en syreoppløsning med en konsentrasjon på 0,2 mol / L. Etter å ha droppet syreoppløsningen og til den basiske løsningen ble titrert, ble det observert at 20 ml av syreoppløsningen ble brukt i titrering. Bestem molariteten til basisløsningen som brukes.
Treningsdata:
Vb = 30 ml
Mb =?
Ma = 0,2 mol / l
Va = 20 ml
Ettersom molariteten til syren og dens volum er henholdsvis 0,2 mol / L og 20 ml, og volumet av basen som brukes er 30 ml, er det bare å bruke titreringsformelen:
Ma.Va = Mb.Vb
0.2.20 = Mb.30
4 = Mb.30
4 = Mb
30
Mb = 0,133 mol / l
Av meg. Diogo Lopes Dias
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
DAGER, Diogo Lopes. "Volometrisk analyse eller volumetri"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/analise-volumetrica.htm. Tilgang 28. juni 2021.