DE bindende energi er involvert i pausenellerunder opplæring av en eller flere bindinger mellom atomer i et molekyl. Hydrogengassmolekylet har for eksempel en enkeltbinding (sigma) mellom de involverte atomene:

Strukturformel for hydrogengass
For at dette molekylet skal ha sin opprinnelse, ble enkeltbindingen mellom dets atomer dannet. Når dette molekylet deltar i en kjemisk reaksjon med klorgass (Cl2), for eksempel for dannelse av saltsyre (HCl), enkeltbindingene som er tilstede i H2 og i kl2 må brytes med den påfølgende dannelsen av en enkeltbinding i HCl.
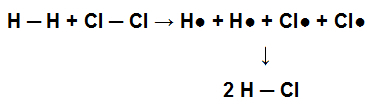
Representasjon av brudd på enkeltbindinger i reagenset og dannelse av en enkeltbinding i produktet
Atomer binder seg sammen for å oppnå sine elektronisk stabilitet, det vil si at de beveger seg fra en høyere energisituasjon til en lavere energisituasjon. Dermed kan vi si at når båndet mellom atomer dannes, frigjøres energi; derfor avhenger dets nedbrytning av energiabsorpsjon.
Hvis vi forstår det bruddet (brudd) av en kjemisk binding skjer når den tilføres den
en mengde energi (xKcal), konkluderte vi med at dette er en prosess endotermisk. I motsetning til det å danne en obligasjon vil involvere utgivelse gir samme mengde energi (-xkcal)å være en prosess eksoterm.Som kjemiske reaksjoner er klassifisert i endoterm eller eksoterm, kan vi bruke kunnskap om bindingsenergiene til molekylene i reaktanter og produkter for å bestemme endringen i energi (ΔH) i den kjemiske prosessen og deretter klassifisere den.
Se for eksempel ligningen nedenfor:
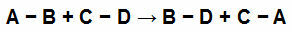
Kjemiske obligasjoner i deltakere i en kjemisk ligning
Vi har enkle lenker i hver av reaksjonsdeltakerne. De har følgende verdier:
[A-B] = 50 Kcal
[CD] = 100 Kcal
[B-D] = 80 Kcal
[B.C] = 230 Kcal
Med verdiene ovenfor kan vi beregne energien som er involvert i å bryte bindingen av reaktanter og danne bindingen av produkter som følger:
I reagenser
50 Kcal for å bryte AB-obligasjonen og 100 Kcal for å bryte CD-binding, det vil si i reagenset, 150 Kcal vil bli brukt til å bryte bindingene.
I produkter
80 Kcal for å danne BD-binding og 230 Kcal for å danne AC-bindingdet vil si at 310 Kcal frigjøres i produktet ved dannelse av obligasjoner
Med verdiene til energiene involvert i reaktantene og produktene, er det mulig å vite om reaksjonen har absorbert eller frigjort mer energi bare ved å trekke energien brukt i forstyrrelsen fra energien som frigjøres i formasjon:
ΔH = Energi av reagenser - Energi av produkter
ΔH = 230 - 310
ΔH = -80 Kcal
Ikke stopp nå... Det er mer etter annonseringen;)
Ettersom reaksjonen har mer energiutslipp enn absorpsjon, er negativ Ah derfor eksoterm.
MERK: Hvis deltakerens støkiometriske koeffisient er forskjellig fra 1, må vi multiplisere energiværdien til forbindelsen med koeffisienten, for eksempel:
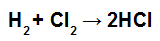
HCl formasjonsligning
Siden koëffisienten til HCl er 2, må vi multiplisere verdien av bindingen av HC1 med 2.
Følg nå oppløsningen til en øvelse om bindende energi i en kjemisk reaksjon:
Eksempel: Gitt følgende bindingsenergier, i kilojoule per mol obligasjoner (absolutte verdier):
H - H = 436
N ≡ N = 945,6
N - H = 391
Beregn varmen (i kilojoules per mol NH3 (g)) involvert i reaksjonen representert av:
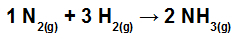
Kjemiske bindinger i NH-dannelsesreaksjonen3
Vedtak:
Det første trinnet i å løse denne øvelsen er å omskrive ligningen som er gitt for å demonstrere de kjemiske bindingene i hvert av molekylene:
Ikke2: vi har en trippelbinding (fordi N, familien av nitrogen, må lage tre bindinger fordi den har fem elektroner i valensskallet);
på H2: Vi har en enkeltbinding (fordi H må bare lage en binding fordi den bare har ett elektron i valensskallet);
i NH3: Vi har tilstedeværelse av tre enkle obligasjoner (fordi hver H trenger en binding, og N, tre obligasjoner).
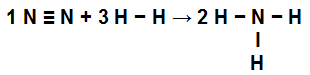
Ligning som viser koblingene i NH-formasjonen3
Ettersom øvelsen ga verdiene for hver binding, er det første trinnet å bestemme bindingsenergien knyttet til hver av deltakerne:
- Til N2
Vi har 1 føflekk i N2i ligningen og for å bryte forbindelsen din trenger vi 945,4 KJ, derfor:
1.945,4 = 945,4 KJ
- Til H2
Vi har 3 mol i H2i ligningen og for å bryte forbindelsen din, trenger vi 436 KJ, derfor:
3.346 = 1038 KJ
- Til NH3
Vi har 2 mol NH3i ligningen, men det er tre ganger N-H-bindingen, så la oss multiplisere mengden energi som er involvert for å danne den bindingen med 2 og med 3:
2.3.391 = 2346 KJ
Til slutt kan vi bestemme varmen som er involvert i reaksjonen ved å trekke energien som brukes til å bryte reaktanten fra energien som frigjøres ved dannelsen av produktet:
ΔH = energi i reaktanter - energi i produkter
ΔH = (945,4 + 1038) - 2346
ΔH = 1983,4 - 2346
ΔH = - 362,6 KJ per mol NH3 (g)
Ettersom variasjonen var negativ, betyr det at energien som frigjøres i dannelsen av bindinger i produktene var større enn energien absorbert i å bryte bindingen til reaktantene, derfor reaksjonen er eksoterm.
Av meg. Diogo Lopes Dias


