Du Hydrokarboner er komponert dannet av karbon (C) og hydrogen (H). Fleksibiliteten til karbon, som er hovedelementet i disse forbindelsene, favoriserer eksistensen av et stort mangfold av strukturer Derfor kan noen egenskaper, som smeltepunkt og kokepunkt, variere mellom ett hydrokarbon og et annet.
De er for det meste molekyler apolar, med styrkes intermolekylær indusert dipoltype og tetthet mindre enn De fra vann. Identifikasjonen av disse forbindelsene kan gjøres gjennom nomenklaturen, som følger reglene etablert av International Union of Pure and Applied Chemistry (Iupac).
Les også: Karbon - et av de mest utbredte elementene i universet
Egenskaper av hydrokarboner

Polaritet: hydrokarboner uten tilstedeværelse av heteroatomer er apolar.
Intermolekylære krefter: bindingen mellom molekylene i et hydrokarbon er av typen indusert dipol.
smeltepunkt og ogkokende: de varierer i henhold til størrelse, funksjon og strukturell organisering av molekylet.
fysisk tilstand: under normale temperatur- og trykkforhold er hydrokarboner med fire eller færre karbonatomer i gassform. De med 5 til 17 karbon er i flytende tilstand, og hydrokarboner med mer enn 17 karbon er faste stoffer.
Tetthet: er mindre enn tetthet vann, dvs. mindre enn 1,0 g / cm3.
Reaktivitet: alifatiske og umettede hydrokarboner er dårlig reaktive; umettede forbindelser reagerer mer sannsynlig med andre molekyler, og sykliske hydrokarboner med opptil fem karbon er veldig reaktive.
Klassifisering av hydrokarboner
Hydrokarboner kan klassifiseres etter den strukturelle organisasjonen av kjeden og av etablissementene.Umettet er tilstedeværelsen av dobbelt (e) eller trippelbinding mellom karbon, er forekomsten av pi-tilkoblinger (π). allerede den grener de er som "grener" festet til en større hydrokarbonstruktur. Sykliske kjeder kan også inneholde grener og / eller umettninger - den strukturelle organiseringen av lukkede hydrokarboner danner polygoner som firkant, trekant, heksan, blant andre.
Når det gjelder arrangementet av atomer, kan et hydrokarbon ha en normal eller forgrenet kjede.
→ C hydrokarbonnormal, lineær eller rett linje: den med en streng som bare har to ender.

→ C hydrokarbonhater forgrenet: den med en kjede som har mer enn to ender. For å vite hvor og hva grenene er, er det viktig å velge hovedkjeden riktig. Hovedkjeden må inneholde alle umettninger og heteroatomer (hvis noen), i tillegg til det største antallet sekvensielle karbonatomer. Karboner som ikke inngår i hovedkjeden er grener.
Eksempel:

Med hensyn til "lukking" kan et hydrokarbon ha en lukket, åpen eller blandet kjede.
→ Kjede hydrokarboners lukket eller syklisk: de med kjeder der atomer organiserer seg og danner en syklus, en polygon eller en aromatisk ring (lukket hydrokarbon med alternerende umettninger). Ikke ha løse ender med mindre det er en gren. Hvert toppunkt på polygonet representerer et karbon og dets respektive hydrogenbindingsmidler.
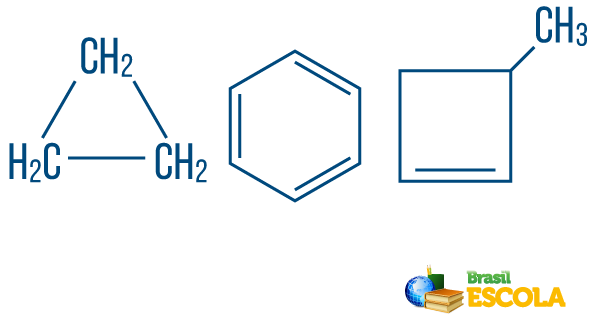
→ Åpen kjede eller asykliske hydrokarboner: er de med kjeder som har minst to ender.

→ Hydrokarbon av blandet type streng: er dannet av en ring eller en syklisk kjede festet til en lineær del; den har minst en ende.
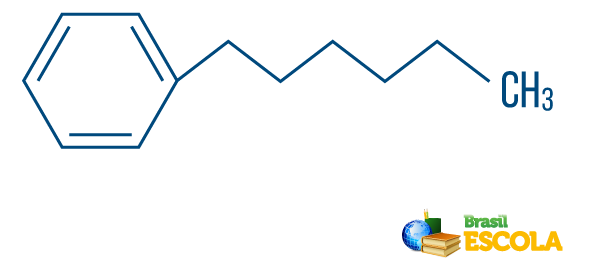
Les også: Aromatiske hydrokarboner - eksempler og egenskaper
Nomenklatur for hydrokarboner
For hver type hydrokarbon er det en navngivningsregel etablert av Iupac. Nomenklaturen for disse forbindelsene gjøres som følger:
1. del: lokasjon og navn på filial (er) (hvis noen);
2. del: begrepet gjelder syklus hvis forbindelsen er en lukket kjede, men hvis det er en alifatisk (åpen) kjede, vil det ikke være nødvendig;
3. del: prefiks som indikerer hvor mange karbon det er i hovedkjeden;
4. del: plassering og infiks som indikerer typen umettethet i molekylet;
5. del: suffiks “o” riktig for hydrokarboner.
Hvis molekylet har en åpen struktur, uten forgrening, starter nomenklaturen i del 3.
Følgende tabell viser den nødvendige informasjonen (prefiks, infiks og suffiks) for hydrokarbonnomenklatur generelt. O prefiks varierer med antall karbonatomer; O infix, i henhold til antall umettninger; det er suffiks“O " refererer til forbindelser av hydrokarbon-typen.
Prefiks |
Infix |
Suffiks |
||
1 karbon |
møtte- |
Bare enkeltanrop |
-an- |
-O |
2 karbonatomer |
et- |
|||
3 karbonatomer |
rekvisitt- |
1 dobbeltbinding |
-en- |
|
4 karbonatomer |
men- |
|||
5 karbonatomer |
pent- |
2 dobbeltbindinger |
-dien- |
|
6 karbonatomer |
heks- |
|||
7 karbonatomer |
hept- |
1 trippelbinding |
-i- |
|
8 karbonatomer |
okt- |
|||
9 karbonatomer |
ikke- |
2 trippel lenker |
-diin- |
|
10 karbonatomer |
avgjøre |
Det første trinnet i å oppdage nomenklaturen til en organisk forbindelse er identifisere hovedkjeden av karbon, som må inneholde umettelsene og så mange sekvensielle karbon som mulig. Etter å ha identifisert hovedkjeden, karbon må oppregnes - starter tellingen fra siden nærmest grenene og umettelsene (hvis noen). DE lokalisering vil være antallet karbon der forgreningen eller umettingen er funnet. Noen ganger er det bare ett mulig sted for en radikal eller dobbelt eller tredobbelt binding, så det er ikke nødvendig å uttrykke plasseringen av det koblende karbonet i nomenklaturen.

DE nomenklatur for grener vil bli gitt av antall karbonatomer i hver, pluss avslutning linje eller ll. Når det er mer enn en gren, brukes alfabetisk rekkefølge.
Se eksemplene nedenfor:
→ Eksempel 1
CH3 - CH2 - CH3 → Propan
1. del: prefikset “rekvisitt-”Indikerer at kjeden har tre karbonatomer.
2. del: infiks "-an-”Signaliserer at molekylet bare lager forbindelser av typen sigma eller enkelt.
3. del: suffikset "-O”Er karakteristisk for hydrokarboner.
→ Eksempel 2
CH2= CH-CH2-CH3 → But-1-en
I hydrokarboner med umettethet er det nødvendig å nummerere og lokalisere karbonet som paret finnes i, og nummereringen må være så liten som mulig. For dette må karbonantallet starte med siden nærmest dobbeltbindingen.
1. del: "men-" indikerer at det er fire karbonatomer i kjeden.
2. del: "1-no" refererer til umettet plassert mellom karbon 1 og 2.
3. del: "-O" er det karakteristiske suffikset til hydrokarboner.
→ Eksempel 3

1. del: "3-etyl" signaliserer at det er en to-karbon gren på karbon 2.
2. del: "-pent-" indikerer tilstedeværelsen av fem karbonatomer i hovedkjeden.
3. del: "-an-" er infiks brukt på umettede kjeder (ingen dobbelt- eller trippelbindinger).
4. del: "-O" er det karakteristiske suffikset til hydrokarboner.
→ Eksempel 4
For kjeder med mer enn en gren, plasser radikalene i nomenklaturen i alfabetisk rekkefølge. Hvis det er grener og umettninger i det samme molekylet, bør antallet karbon i hovedkjeden gjøres på en slik måte at summen av plasseringstallene er så liten som mulig.
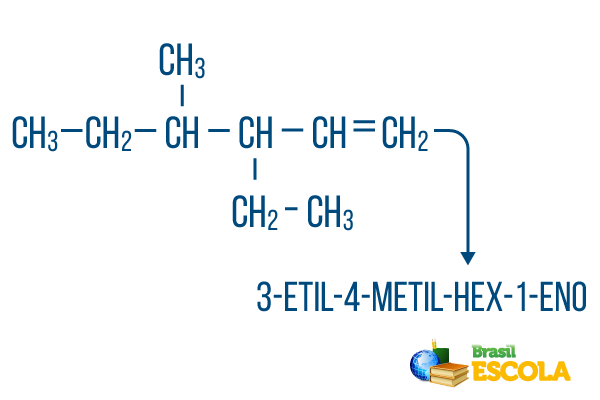
Hovedkjede karbonantallet ble gjort fra venstre til høyre, og summen av tallene for umettethet og grenplassering er: 1 + 4 + 3 = 8. Hvis karbonantallet hadde vært fra høyre til venstre, ville den sammensatte nomenklaturen være 4-etyl-3-metyl-5-en, hvis sum av lokasjoner vil være: 4 + 3 + 5 = 12, som er større enn den andre hypotesen, så den bør ikke brukes.
1. del: 3-etyl-4-metyl viser til radikalene i alfabetisk rekkefølge og deres respektive plasseringer.
2. del: heks- betyr at det er 6 karbonatomer i hovedkjeden.
3. del: 1-en indikerer tilstedeværelsen av en dobbeltbinding på karbon 1.
4. del: "-O" er det karakteristiske suffikset til hydrokarboner.
→ Eksempel 5
For lukkede strenger holder navngivningsreglene, men ordet syklus starter navnet på forbindelsen, noe som indikerer at det er et lukket eller syklisk hydrokarbon.
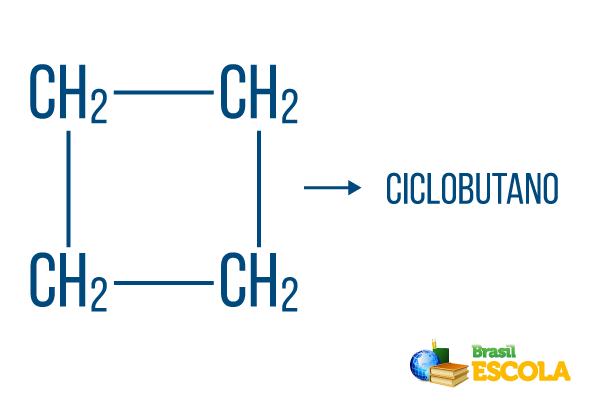
1. del: syklus- indikerer at det er en lukket streng.
2. del: -men- betegner eksistensen av 4 karbonatomer i kjeden
3. del: -Oer det karakteristiske suffikset til hydrokarboner.
Les også: Klassifisering av karbonkjeder
Typer hydrokarboner
Hydrokarboner kan deles inn i alkaner, alkener, alkyner og alkadierer - som er klassifisert som i henhold til etableringen av kjeden (dobbelt (e) eller tredobbelte obligasjoner) - og syklaner, som er kjedene lukket.
→ Alkanes: er hydrokarboner som ikke har umettethet. Den generelle formelen for alkaner er CNeiH2n + 2, og Neiomenklatur den er komponert av prefiks + en + O.
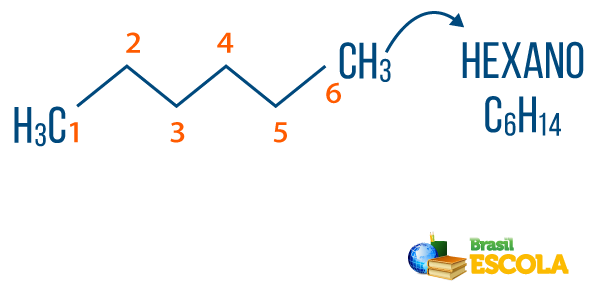
Du alkaner finnes i naturen, som gass metan (CH4), som frigjøres av dyr og produseres i nedbrytningsprosesser, så vel som i raffinerier og petrokjemisk industri. Forbindelser som propan (Ç3H7), butan (Ç4H10), som utgjør vår kokegass (LPG), og oktan (Ç8H18), som finnes i bilbrensel, er biprodukter av Petroleum.

→ alkener eller alkener: er karbonkjeder som har en umettethet, en dobbeltbinding. Den generelle formelen er CNeiH2n, og dine Neiomenklatur den er komponert av Prefiks + no + o.

O etylengass (Ç2H4), brukt i landbruket for å akselerere modningen av frukt, tilhører funksjonen alken. Forbindelsen brukes også til produksjon av råvarer polyetylen, brukt til fremstilling av plastutstyr.
→ Alkynes eller acetylenisk: hydrokarboner med trippelbinding. Den generelle formelen er CNeiH2n - 2. DE nomenklatur den er komponert av prefikset + i + o.

O acetylen eller etin (C2H2) er en gass med alkynefunksjonen som brukes i sveiser og metallskjæringer. Denne forbindelsen kan nå temperaturer på opptil 3000 ° C, noe som gjør at reparasjoner kan utføres på nedsenkede deler av et skip.

→ alkadiene eller diener: karbonkjeder med to umettninger, det vil si to dobbeltbindinger mellom karbon. Den generelle formelen for denne funksjonen er C.NeiH2n - 2. Innse at det er den samme formelen som alkyner, noe som betyr at det kan skje isomerisme mellom forbindelser (samme molekylformel for forskjellige forbindelser).
Nomenklaturen til en alkadien er sammensatt av Prefiks + dien + o.
Eksempel:

→ Lukkede hydrokarboner: molekylene organiserer seg på en syklisk måte, har en tendens til å danne en polygon og, akkurat som i åpne kjeder, kan etableringer og / eller forgreninger forekomme. Sykloner, syklener, sykliner og benzener er hydrokarboner med lukket kjede.
Sykloner eller cykloalkaner: sykliske kjeder som bare består av enkeltbindinger. Den generelle formelen er CNeiH2n. Nomenklatur: ciclo + prefiks + an + o.
Sykler eller sykloalkener: lukkede hydrokarbonkjeder med etablering. Den generelle formelen er CNeiH2n-2. Nomenklatur: çiclo + prefiks + no + O.
-
Sykliner eller sykloalkiner: lukkede hydrokarboner med nærvær av to dobbeltbindinger. Den generelle formelen er CNeiH2n-4. Nomenklatur: çiclo + prefiks + i + o.
benzener
Benzen er en type hydrokarbon med lukket kjede med seks karbonatomer hvor obligasjonene varierer mellom enkelt og dobbelt. Disse forbindelsene er giftig og svært kreftfremkallende, blir brukt som organiske løsningsmidler i kjemiske prosesser.
For at hydrokarbonet skal betraktes som aromatisk, må det være minst ett benzenring, som er svært reaktiv, derfor underlagt to eller flere erstatninger, som vi ser her som forgreninger. Når det er to koblingsradikaler, vil vi ha spesifikke navn for hvert par posisjoner.
Radialer på 1,2 karbon benzen → orto
Radikaler ved 1,3 karbon benzen → mål
Radialer på karbon1,4 av benzen → til
Annomenklatur for en aromatisk forbindelse gjøres som følger:
1. del: posisjonering av ligandene (orto, mål eller til).
2. del: navnet på radikalene eller radikalene festet til benzen (metyl, etyl, propyl ...). Navnet gitt til radikaler følger regelen om andre hydrokarboner.
- 3. del: -Bgift, som er det karakteristiske uttrykket for aromatiske hydrokarboner.
Eksempler:
→ Orto-dimetyl-benzen

1. del: Orto- indikerer at radikalene er plassert på karbon 1 og 2.
2. del: -dimetyl- refererer til de to radikalene, begge med ett karbon.
3. del: -benzen er det karakteristiske begrepet for aromatiske hydrokarboner.
→ Orto-etyl-metyl-benzen
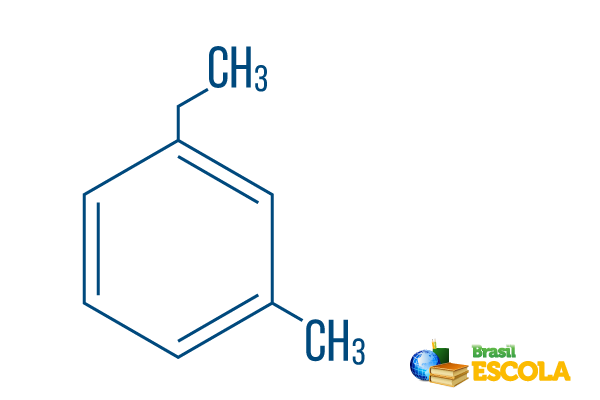
1. del: mÅh- indikerer at radikalene er plassert ved karbon 1 og 3.
2. del: etyl-metyl- refererer til mengden karbon i hver radikal, vesen etyl De to-karbon gren og metyl forgrening med ett karbon - plassert i nomenklaturen i alfabetisk rekkefølge.
3. del: -benzen er det karakteristiske begrepet for aromatiske hydrokarboner.
→ Para-dietyl-benzen
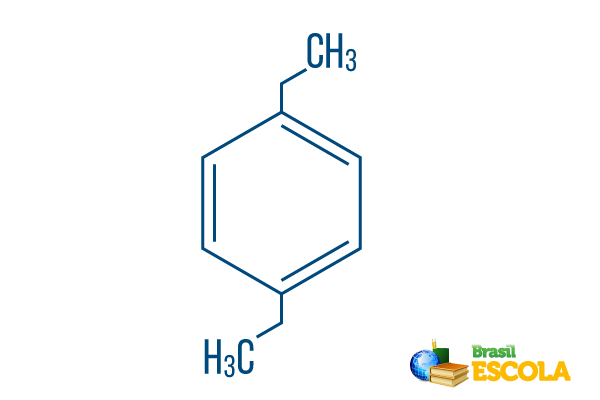
1. del: Pplog- indikerer at radikalene er på karbon 1 og 4 av benzen.
2. del: -dietyl- refererer til to radikaler av typen etyl, det vil si to grener med to karbonat hver.
3. del: -benzen er det karakteristiske begrepet for aromatiske hydrokarboner.
Les også:Oppdagelse av strukturen til benzen
løste øvelser
(Unesp) - Oktan er en av hovedbestanddelene av bensin, som er en blanding av hydrokarboner. Molekylformelen til oktan er:
a) C8H18
b) C8H16
c) C8H14
d) C12H24
e) C18H38
Svar: bokstav a). Analyse av sammensatt nomenklatur oktan, det er en alkan, det vil si et molekyl som bare består av enkeltbindinger. Hvis den generelle formelen for alkaner er CNeiH2n + 2Ved å erstatte "n" med åtte, som er mengden karbon i hovedkjeden - og unik i dette tilfellet - vil vi ha at molekylformelen til oktan er C8H18.
(UFSCar-SP) - Tenk på følgende utsagn om hydrokarboner.
I) Hydrokarboner er organiske forbindelser som bare består av karbon og hydrogen.
II) Bare rettkjedede umettede hydrokarboner kalles alkener.
III) Sykloalkaner er mettede alifatiske hydrokarboner med den generelle formelen CnH2n.
IV) Er aromatiske hydrokarboner: brombenzen, p-nitrotoluen og naftalen.
Følgende utsagn er korrekte:
a) bare I og III.
b) Bare I, III og IV.
c) Bare II og III.
d) Bare III og IV.
e) Bare I, II og IV.
Svar: Bokstav a).
II - Alkener er forbindelser med dobbeltbinding, det vil si umettet, men de kan ha forgreninger i kjeden sin, og ikke utelukkende lineære.
IV - Brometobensen- og p-nitrotoluenforbindelsene tilhører andre organiske funksjoner.
av Laysa Bernardes
Kjemi lærer
Kilde: Brasilskolen - https://brasilescola.uol.com.br/quimica/hidrocarbonetos.htm

