På intermolekylære krefter er et tema i kjemi som helt sikkert kan vises i National High School Exam (Og enten). Derfor er det verdt å sjekke ut hovedinnholdet i dette emnet i denne artikkelen.
Definisjon
intermolekylære krefter de er krefter - av varierende intensitet (svak, middels eller sterk) - av elektrostatisk tiltrekning eller bindinger etablert mellom molekylene til et stoff som opprettholder foreningen mellom dem.
Typer intermolekylære krefter
De) Indusert dipol
Og intermolekylær kraft som oppstår mellom molekyler av et stoff med en ikke-polær karakteristikk. Det skjer for eksempel mellom molekyler av stoffer som O2, H2, Nei2, CO2, CH4.
Forbindelsen mellom disse molekylene oppstår når det dannes en dipol mellom dem. Dette skjer når elektronene til et molekyl fortrenger elektronene til et annet, og derved skaper en negativ og en positiv pol som overføres fra ett molekyl til et annet.
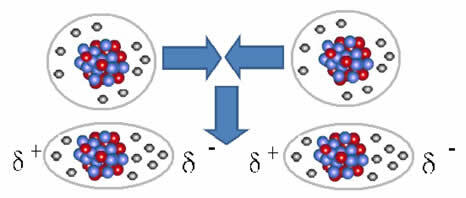
Representasjon av dipoldannelse i ikke-polare molekyler
Mellom disse molekylene ble det dannet to poler, og den negative polen til den ene interagerer med den positive polen til den andre. Fordi disse polene ble opprettet, er det en intermolekylær kraft med lav intensitet.
B) permanent dipol
Og intermolekylær kraft som oppstår mellom molekyler av et stoff med en polar karakteristikk. Eksempler er molekyler av stoffer som HCN, H2O, NH3, CO, CH3Cl.
Foreningen mellom disse molekylene skjer når den ene negativens pol samhandler med den andre.
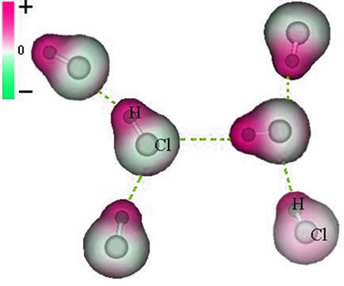
Representasjon av den permanente dipolkraften mellom HCl-molekyler
Ettersom polene allerede eksisterer, har den permanente dipolintermolekylære kraften større intensitet enn den induserte dipolen.
ç) hydrogenbindinger
At intermolekylær kraft det forekommer mellom polare molekyler som har et hydrogenatom bundet direkte til et oksygen-, nitrogen- eller fluoratom.
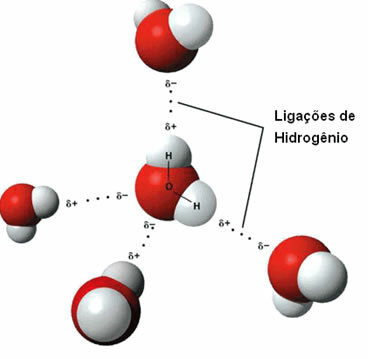
Representasjon av hydrogenbindinger mellom vannmolekyler
En hydrogenbinding dannes når hydrogenet i det ene molekylet samhandler med oksygen, nitrogen eller fluor fra det andre molekylet.
d) dipolion
Denne intermolekylære kraften oppstår mellom et polært molekyl, som har et par ikke-bindende elektroner, og et ion (kation eller anion) i løsningen.
Vannmolekylet har for eksempel to par ikke-bindende elektroner i oksygen. Hvis det er ioner i det vandige mediet, kommer de nærmere vannmolekylet, da det er poler i det.
Ikke stopp nå... Det er mer etter annonseringen;)
Betydning
Viktigheten av å kjenne intermolekylære krefter for Enem det er forståelsen de gir om de fysiske tilstandene, smeltepunktet, kokepunktet og stoffenes løselighet.
De) Forholdet til stoffets smelte- og kokepunkt
Smeltepunktet indikerer temperaturen på overgangen fra et fast stoff til en flytende tilstand, og kokepunktet indikerer temperaturen på overgangen fra en væske til en gassform.
Denne passasjen er direkte relatert til interaksjonen mellom stoffets molekyler, da det som skiller en fysisk tilstand fra en annen er aggregasjonsnivået mellom molekylene.
Dermed, jo mer intens den intermolekylære kraften er, desto høyere er smelte- og kokepunktene. Jo mindre intens den intermolekylære kraften er, desto lavere er smelte- og kokepunktene. Dermed kan vi definere den synkende rekkefølgen av smelte- og kokepunkt:
Hydrogenbinding> permanent dipol> indusert dipol
B) Forhold til løselighet
Generelt bør vi vite at som oppløser som, det vil si polært stoff, oppløser polært stoff og ikke-polært stoff oppløser ikke-polært stoff.
Imidlertid er det fremdeles muligheten for interaksjon mellom de oppløste molekylene og løsemiddelmolekylene. Dette skjer bare hvis denne nye interaksjonen er større enn det som allerede eksisterer mellom selve stoffets molekyler.
Eksempel på anvendelse av intermolekylær kraft i Enem
Første eksempel: (Enem-2011) Menneskelig hud, når den er godt hydrert, får god elastisitet og et mykt og glatt utseende. På den annen side, når den er tørr, mister den elastisiteten og virker ugjennomsiktig og grov. For å forhindre tørr hud er det nødvendig når det er mulig å bruke fuktighetsgivende fuktighetskrem, vanligvis laget av glyserin og polyetylenglykol:

Vannretensjonen på hudoverflaten fremmet av fuktighetskremer er en konsekvens av samspillet mellom hydroksylgruppene i fuktemidlene og fuktigheten i miljøet gjennom:
a) ioniske bindinger
b) London-styrker
c) kovalente bindinger
d) dipol-dipolkrefter
e) hydrogenbindinger
Svaret på dette spørsmålet er hydrogenbinding, fordi vannmolekylet har hydrogen bundet til et oksygenatom. Det samme skjer med molekylene propylenglykol og polyetylenglykol, en gunstig tilstand for forekomst av denne typen intermolekylær kraft.
Av meg. Diogo Lopes Dias
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
DAGER, Diogo Lopes. "Intermolekylære styrker i fiende"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/forca-intermoleculares-no-enem.htm. Tilgang 27. juni 2021.