Som vist i tekstene "Elektromagnetisk spektrum av kjemiske elementer"og"Emisjon og absorpsjon Spectra og Kirchhoffs lover”, De diskontinuerlige utslippsspektrene til hvert kjemisk element er forskjellige.

Så nedenfor har vi de forskjellige spektrene til noen av disse elementene:

Dermed innså den danske fysikeren Niels Böhr (1885-1962) at dette kunne være relatert til strukturen til atomet til hvert av disse elementene. Så han foreslo en atommodell som komplementerte Rutherfords modell, men fokuserte på oppførselen til omkringliggende elektroner i atomkjernen.
En tid tidligere hadde Max Planck (1858-1947) foreslått en teori om at elektroner er det kvantisert, i den forstand at de avgir og absorberer bestemte mengder energi, som om de var små pakker med energi, som han kalte hvor mye (kvante, i entall).
Dermed foreslo Böhr følgende: siden hvert element har et annet spekter, har hvert element i sine atomelektroner med konstante og forskjellige energier fra element til element.
Hvert elektron kan bare holde seg i en bestemt spesifikk bane, fordi i hver av disse banene har elektronet konstant, veldefinert og karakteristisk energi. Elektronet kan bare oppta energinivået som det har den respektive energien til.
Spektre er diskontinuerlige fordi elektroner kvantiseres.
Et elektron kan bare endre nivåer hvis det absorberer energi. For eksempel, når du brenner et natriumsalt i en Bunsen-brenner, leverer du energi til elektronene. Når du absorberer et kvantum energi, hopper elektronet til et annet mer energisk nivå og holder seg i den begeistrede tilstanden. Jordtilstanden er imidlertid mer stabil, så dette elektronet avgir den absorberte energien og går tilbake til sin opprinnelige bane. Den avgir denne energien i form av elektromagnetiske bølger som kan visualiseres i form av lys. Når det gjelder natrium, har dette lyset en intens gul farge. Når disse bølgene passerer gjennom et prisme, oppnås det diskontinuerlige spekteret av natrium.
Så for Böhr, hver lysende linje som dukket opp i det diskontinuerlige spekteret av elementene, indikerte energien som ble frigitt da elektronet kom tilbake fra ett ytre nivå til et nærmere kjernen.
Figuren nedenfor hjelper deg med å forstå dette problemet bedre:
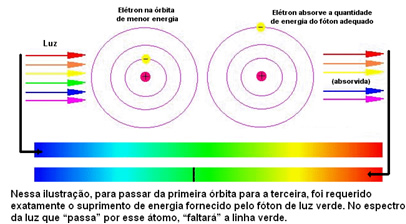
Ettersom atomene til hvert element bare er tillatt visse energiverdier som tilsvarer energilagene, er det for hvert element et annet spektrum.
Av Jennifer Fogaça
Uteksamen i kjemi
Kilde: Brasilskolen - https://brasilescola.uol.com.br/quimica/espectros-eletromagneticos-estrutura-atomo.htm

