intermolekylære krefter de er måtene molekylene av forbindelser (polære eller ikke-polare) dannet av kovalente bindinger samhandler med hverandre. De ble foreslått i året 1873 av den nederlandske kjemikeren og fysikeren Diderik Van der Waals.
Ifølge Van der Waals kan molekyler samhandle forskjellig med hverandre. Disse forskjellige interaksjonene har stor innflytelse på smeltepunkt (MP) og kokepunkt (PE) av stoffer. Dermed definerer intensiteten molekylene samhandler med fysisk tilstand (fast, flytende eller gassformig)).
Å oppfatte eksistensen av forskjellige intermolekylære krefter (interaksjoner) er enkelt, siden vi i naturen kan finne den samme saken i forskjellige fysiske tilstander. Bli kjent med de tre typene intermolekylære krefter som kan eksistere mellom stoffer dannet av kovalente bindinger:
→ London-krefter eller dipolindusert
Det er den typen kraft som oppstår mellom ikke-polare molekylerdet vil si molekyler som ikke har poler (positive og negative), ettersom elektronene er jevnt fordelt i deres elektrosfær, som på bildet nedenfor:
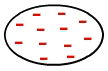
Ensartet fordeling av elektroner i et ikke-polært molekyl
Imidlertid kan elektroner på et eller annet tidspunkt akkumuleres i et område av et molekyl, og skape en negativ og en positiv pol i det. Ettersom dette molekylet er nær det andre, ender denne midlertidige dipolen med at elektronene fra det andre molekylet klumper seg sammen i den ene enden, og så videre:

Dannelse av en midlertidig dipol i et ikke-polært molekyl
Dermed har molekyler som ikke er polare, nå en dipol som ble indusert.
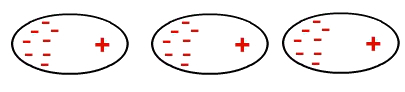
Samspillet mellom ikke-polære molekyler skjer indusert
Noen eksempler på stoffer hvis molekyler samhandler med denne typen krefter er: karbondioksid (CO2), metangass (CH4), etangass (C2H6) og hydrogengass (H2).
Ikke stopp nå... Det er mer etter annonseringen;)
→ Permanent dipol eller dipol-dipol styrke
Det er en slags intermolekylær kraft som oppstår mellom polare molekyler (unntatt de som har elementet hydrogen direkte knyttet til fluor, oksygen eller nitrogen). Noen eksempler på stoffer hvis molekyler samhandler med dipol-dipol er saltsyre (HCl), svoveldioksid (SO2), hydrobromsyre (HBr) og hydrocyansyre (HCN).
Ettersom molekylene er polare (de har positive og negative poler), interagerer de slik at den negative polen til den ene forenes med den positive polen til den andre, og så videre:
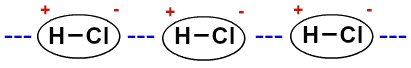
Representasjon av den permanente dipolen mellom saltsyremolekyler
På grunn av tilstedeværelsen av dipolen, siden molekylene er polare, er dipol-dipol-interaksjonen mer intens enn den induserte dipolen.
→ hydrogenbindinger
Det er en type intermolekylær kraft som også forekommer i polare molekyler, men bare hvis hydrogenatomet er direkte knyttet til ett av de tre kjemiske elementene (fluor, oksygen og nitrogen) pluss elektronegativer av det periodiske systemet.
Noen eksempler på molekyler som vekselvirker ved hydrogenbindinger er: flussyre (HF), ammoniakk (NH3) og vann (H2O).
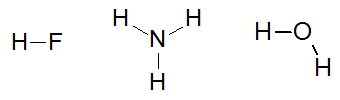
Strukturformler stoffene flussyre, ammoniakk og vann
Hvordan hydrogenbinding oppstår i molekyler hvis elektronegativitetsforskjell mellom atomer er veldig stor er den en intermolekylær kraft med høy intensitet (større enn dipol-dipol og dipol indusert).
Se en representasjon av denne interaksjonen:
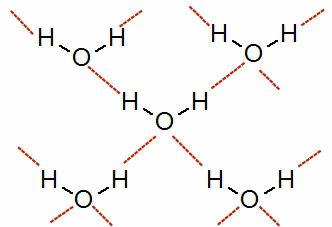
Representasjon av hydrogenbindinger mellom vannmolekyler
Av meg. Diogo Lopes Dias
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
DAGER, Diogo Lopes. "Hva er intermolekylære krefter?"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-sao-forcas-intermoleculares.htm. Tilgang 28. juni 2021.