uorganiske salter de dannes av den ioniske assosiasjonen av minst en kation (dannet av hvilket som helst metall eller av ammonium) og et anion (enkelt eller sammensatt).
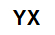
Generell molekylformel av et salt
Når saltet tilsettes vann, dissosieres det, og frigjør minst ett annet kation enn hydronium (H+) og et annet anion enn hydroksid (OH-).
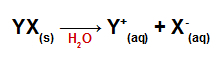
Dissosiasjon ligning for salt
Klassifisering av salter
Salter kan generelt ha følgende klassifiseringer:
enkelt salt: salt dannet av bare ett kation og ett anion. Eksempler: NaCl, CaSO4, KCN, NH4CO3 etc.
Hydrogenert salt: den har to kationer (den ene må være hydronium) og et anion. Eksempler: NaHCO3, CaHBO3 etc.
Hydroksylsalt: den har et kation og to anioner (det ene må være hydroksyd). Eksempler: MgOHCl, Al (OH)2ClO3 etc.
Hydrert salt: presenterer vannmolekyler assosiert med dens krystallinske struktur. Eksempler: CaCl2.2H2O, CuSO4.6H2Den etc.
Dobbelt salt: den har to kationer (alle forskjellige fra hydronium) og en anion eller en kation og to anioner (alle forskjellige fra hydroksid). Eksempler: Type4CN, AgFeBO3 etc.
Alum: er saltet dannet av to sulfater med NOx-kationer lik +1 og +3, pluss 24 molekyler vann. Eksempler: Ag2KUN4.Al2(KUN4)3.24H2på en2KUN4.Sb2(KUN4)3.24H2O
Saltnavnregel
Anionnavn + de + kationnavn
→ K3STØV4
Salt har fosfatanionen (PO4-3) og kaliumkation (K+1), derav navnet er kaliumfosfat.
→ Sak3
Saltet har sulfittanion (SO3-2) og kalsiumkation (Ca+2), derav navnet er kalsiumsulfitt.
MERK: Hvis kationen ikke er sølv, sink eller et element som tilhører IA-, IIA- og IIIA-familiene, må vi indikere NOX-en med et romertall foran kationens navn.
→ Cu2KUN4
Saltet har sulfatanionet (SO4-2) og kalsiumkation (Cu+1), derav navnet er kobbersulfat I.
Hydrogenert salt: For dette saltet, før anionnavnet, må vi skrive prefikset med referanse til mengden hydrogen i formelen. Dette prefikset må være skilt fra ordet hydrogen av en bindestrek.
→ NaHCO3
Salt har et hydrogen-, karbonatanion og natriumkation, så navnet er natriummonohydrogenkarbonat.
Hydroksylsalt: For dette saltet, før anionnavnet, må vi skrive prefikset med referanse til mengden hydroksyler i formelen. Dette prefikset må være skilt fra ordet hydroksy av en bindestrek.
→ Al (OH)2ClO3
Saltet har to hydroksyler, kloratanionet og aluminiumkationen, så navnet er aluminiumdihydroksyklorat.
Ikke stopp nå... Det er mer etter annonseringen;)
Hydrert salt: For dette saltet, etter navnet på kationen, må vi skrive prefikset med henvisning til mengden vannmolekyler i formelen. Dette prefikset må være skilt fra ordet hydrert av en bindestrek.
→ CaCl2.2H2O
Salt har to vannmolekyler, kloridion og kalsiumkation, så navnet er kalsiumkloriddihydrat.
Dobbelt salt med to kationer: For dette saltet må vi skrive det dobbelte ordet i parentes etter anionnavnet og deretter det mest elektropositive kationnavnet og det andre kationet.
→ AgFeBO3
Dette saltet har sølv (mer elektropositivt kation) og jern II-kation, i tillegg til boratanionet. Navnet er borat (dobbelt) av sølv og jern II.
-
Dobbelt salt med to anioner:
Navnet på det mest elektronegative anionet + bindestrek + navnet på det minste elektronegative anionet + de + kationens navn
→ Type4CN
Dette saltet inneholder titan IV-kation, i tillegg til fosfat (mer elektronegativ anion) og cyanidanion. Navnet er titancyanidfosfat IV.
Alunsalt: For dette saltet ignorerer vi hovedregelen. Bare skriv begrepet alun etterfulgt av henholdsvis +3 ladningskationnavnet og +1 ladningskationnavnet, atskilt med forbindelsen e.
→ I2KUN4.Sb2(KUN4)3.24H2O
Alunsaltet har +3 antimonkation og +1 natriumkation, så navnet er antimon III alun og natrium.
Fysiske egenskaper ved salter
De er solide ved romtemperatur;
De har høye smeltepunkter og kokepunkter;
De er dannet av ioniske bindinger;
De leder en elektrisk strøm i flytende tilstand (etter å ha gjennomgått fusjon) eller når de er oppløst i vann;
Generelt er de oppløselige i vann, men det er salter som anses som praktisk talt uoppløselige.
Kjemiske egenskaper av salter
Salter er forbindelser som har evnen til å reagere kjemisk (forutsatt at de ikke har samme kation eller samme anion som et annet stoff) med flere grupper av stoffer, nemlig:
I en dobbeltbyttereaksjon med en syre: de danner et nytt salt og en ny syre.
I en dobbeltbyttereaksjon med en base: de danner et nytt salt og en ny base.
I en dobbeltbyttereaksjon med et annet salt: danner to nye salter.
Noen salter har evnen til å lide nedbrytning når de utsettes for varme og danner to eller flere nye stoffer. Hvis vi varmer opp natriumbikarbonatet (NaHCO3), for eksempel, vil den spaltes og danne natriumkarbonat (Na2CO3), vann (H2O) og karbondioksid (CO2).
Av meg. Diogo Lopes Dias
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
DAGER, Diogo Lopes. "Hva er uorganiske salter?"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-sao-sais-inorganicos.htm. Tilgang 28. juni 2021.
Hva er kjemi?

Gå til denne lenken og bli kjent med et oksid, måten å identifisere denne viktige gruppen av uorganiske stoffer på, samt navngivningsreglene som brukes til å navngi dem og hovedklassifiseringene (doble, sure, basiske, amfotere og nøytrale) de kan motta.
Kjemi

Sal Light, sammensatt av natriumklorid og kaliumklorid, pasient med høyt blodtrykk, lavt natriuminnhold, metallisk natrium, bordsalt, natriumioner.
Kjemi

Hverdagssalter, kalsiumkarbonat, natriumklorid, natriumfluorid, kaliumnitrat, natriumnitrat natrium, natriumkarbonat, natriumbikarbonat, natriumbikarbonat, natriumsulfitt, saltpeter, soda.