Gass og damp
Forskjellen mellom gass og damp er gitt fra den kritiske temperaturen. Damp er materie i gassform, en tilstand som kan flytes med økende trykk. Bensin er ikke det samme. Det er en væske som ikke kan flytes med en enkel økning i trykk. Dette gjør gass forskjellig fra damp.
Oppførsel av gasser
Et gitt stoff i gassform er en gass hvis temperaturen er høyere enn den kritiske temperaturen, hvis temperaturen er lik eller lavere enn den kritiske temperaturen, er stoffet damp.
De virkelige gassene som vi vanligvis kjenner, for eksempel helium, nitrogen og oksygen, har forskjellige og spesifikke molekylære egenskaper. Men hvis vi setter dem alle ved høye temperaturer og lave trykk, begynner de å vise veldig lignende oppførsel. I studien av gasser er det tatt i bruk en enkel teoretisk modell, som i praksis ikke eksisterer, med oppførsel som ligner den for ekte gasser. Denne tilnærmingen blir bedre jo lavere trykk og jo høyere temperatur. Denne gassmodellen kalles perfekt gass.
Rundt det 17. og 19. århundre var det tre forskere (Jacques Charles, Louis J. Gay-Lussac og Paul E. Clayperon), etter å ha studert oppførselen til gasser, utarbeidet lover som regulerer oppførselen til perfekte gasser, også kalt ideelle gasser. Lovene som er bestemt av dem, etablerer reglene for den “ytre” oppførselen til den perfekte gassen, noe som fører til den teller bare de fysiske størrelsene som er knyttet til dem, som er: volum, temperatur og press.
Generell lov om perfekte gasser
Uttrykket som bestemmer den generelle loven for perfekte gasser kan sees som følger:
Ikke stopp nå... Det er mer etter annonseringen;)
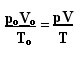
hvor sO, VO og TO er henholdsvis starttrykk, startvolum og starttemperatur. Dette er et uttrykk som brukes til når variablene til en gass varierer.
boyles lov
Robert Boyle, fysiker og kjemiker, var den som bestemte loven som styrer transformasjonene som en gass gjennomgår når temperaturen holdes konstant. Hans lov sier at når en gass gjennomgår en isoterm transformasjon, er dens trykk omvendt proporsjonalt med det okkuperte volumet. Fra denne loven får vi det hvordan TO = T Vi må:
POVO = pV
Karls lov
Charles 'lov er loven som styrer transformasjonene av en perfekt gass til konstant volum. Disse transformasjonene kalles isochoriske eller isometriske transformasjoner. I følge denne loven, når en perfekt gassmasse gjennomgår en isokorisk transformasjon, er trykket direkte proporsjonalt med den absolutte temperaturen. Matematisk kan denne loven uttrykkes som følger:

hvor sO og TO de er henholdsvis utgangstrykket og utgangstemperaturen.
Gay-Lussacs lov
Gay-Lussacs lov er loven som styrer transformasjonene av en perfekt gass ved konstant trykk. Denne loven, til tross for at den hadde navnet Gay-Lussac, hadde allerede blitt oppdaget av fysikeren og kjemikeren A.C. Charles. I følge loven er gassens volum direkte proporsjonalt med den absolutte temperaturen når en gass gjennomgår en isobar transformasjon. Matematisk kan denne loven uttrykkes som følger:

Hvor VO og TO tilsvarer henholdsvis utgangsvolumet og utgangstemperaturen.
Av Marco Aurélio da Silva
Se mer!!
Gass transformasjoner
Vet hva gasstransformasjoner er.
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
SANTOS, Marco Aurélio da Silva. "Studie av gasser"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/fisica/estudo-dos-gases.htm. Tilgang 27. juni 2021.