O maursyre får navnet sitt fordi den første oppnåelsen var gjennom destillasjon av røde maur (fra latin formica = maur), som injiserer denne karboksylsyren gjennom bitt og forårsaker alvorlig smerte, hevelse og kløe.
Imidlertid er dens offisielle nomenklatur metansyre, hvis strukturformel er representert nedenfor:

I tillegg til maur finnes metansyre også i bier, brennesle, furutrær og noe frukt.
Ved romtemperatur er den fargeløs, flytende, etsende, sterk luktende og irriterende. Denne syren brukes som en mordant, i produksjonen av karbonmonoksid, i behandlingen mot revmatisme, i produksjonen av oksalsyre, som et bakteriedrepende middel, som et desinfeksjonsmiddel og i produksjonen av andre produkter Organisk.
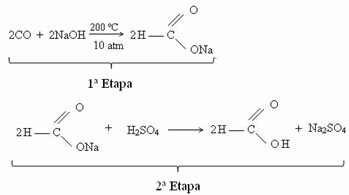
For tiden oppnås maursyre gjennom reaksjonen mellom karbonmonoksid og kaustisk soda. Denne reaksjonen er en teknikk som ligner den som ble utviklet i 1855 av den franske kjemikeren Marcellin Berthelot (1827-1907). Deretter har vi denne reaksjonen, hvor man først oppnår natriummetanoat, som etter reaksjon med svovelsyre produserer metansyre som et av produktene:
Ikke stopp nå... Det er mer etter annonseringen;)
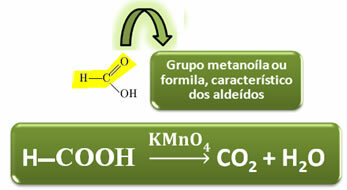
I motsetning til andre karboksylsyrer har maursyre den funksjonelle gruppen av aldehyder, noe som gir den egenskapen til å fungere som en reduseringsmiddel. Reduserer Fehling og Tollens reaktiver, blir oksidert til karbondioksid og vann.
Av Jennifer Fogaça
Uteksamen i kjemi
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
FOGAÇA, Jennifer Rocha Vargas. "Myresyre"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/Acido-formico.htm. Tilgang 28. juni 2021.