Atomer er uendelig små partikler som utgjør all materie i universet. Over tid endret ideen om hvordan atomstrukturen ville være i henhold til nye funn gjort av forskere. Du kan finne ut mer om dette i tekstenUtviklingen av Atomic Model.
En modell er en representasjon av virkeligheten (ikke selve virkeligheten), så atommodeller er representasjoner av hovedkomponentene i atomet og dets struktur og forklare visse fysiske og kjemiske oppførsler av materie. Dette gjøres fordi det ennå ikke er mulig for et menneske å se et isolert atom selv med ultramikroskop.
For å få en ide om hvor lite atomet er, vet du det De Den minste partikkelen som er synlig under et vanlig mikroskop inneholder over ti milliarder atomer! Atomet er så lite at, hvis vi setter en million av dem side om side, ville vi ikke nå tykkelse på et hår.
Tankekart: Atom
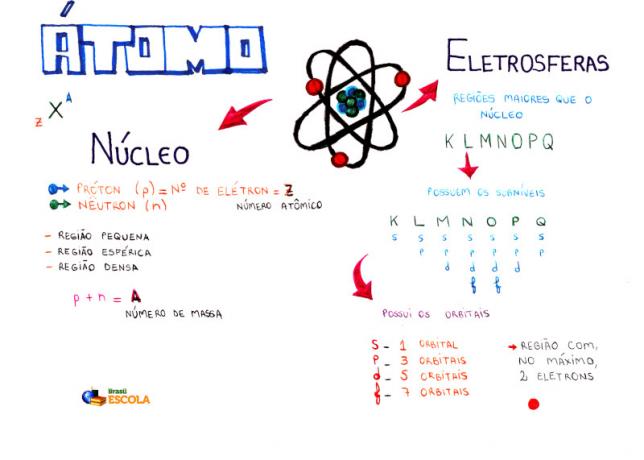
* For å laste ned tankekartet i PDF, Klikk her!
Blant atommodellene, den mest brukte for tiden på videregående skole for å forstå strukturen til atomet og dets egenskaper, er Rutherford-Bohr-modellen. I følge denne modellen består atomens struktur av to hoveddeler:
kjerne og elektrosfæren.
To hoveddeler av strukturen til et atom - elektrosfæren og kjernen
* Kjerne: Konstituerende som den sentrale delen av atomet, er det kompakt, massivt og veldig tett, i tillegg til å være dannet av partikler med større masse, som er protoner og nøytroner.

Illustrasjon av protonene og nøytronene som utgjør atomkjernen
- Protoner: de er partikler med en positiv elektrisk ladning (relativ ladning = +1; ladning i coulomb (C) = +1.602. 10-19) og dens relative masse er lik 1.
Det faktum at protoner danner kjernen og gir den en samlet positiv ladning ble oppdaget av Eugen Goldstein, i 1886, gjennom en modifisering i Crookes ampulle og noen eksperimenter. Han så at under svært høye spenninger oppstod utslipp (anodestråler - rester av atomer av gassen som var inne i pæren og som fikk elektronene deres revet av ved elektrisk utladning). Ved å plassere et elektrisk eller magnetisk felt utenfor pæren ble disse strålene avbøyd mot den negative polen. Dette betydde at det var positive subatomære partikler, som ble kalt protoner.
Seinere, Ernest Rutherford (1871-1937) utførte eksperimentet som er beskrevet i teksten Rutherfords Atom, som førte ham til å oppdage plasseringen av protonen: i kjernen.
- Nøytroner: de er partikler med en masse lik protonene (1), men som navnet antyder, er de nøytrale, det vil si at de ikke har elektrisk ladning.
Nøytroner ble oppdaget i 1932 av James Chadwick (1891-1974), som innså at kjernen av radioaktivt beryllium sendte ut nøytrale partikler med en masse omtrent lik massen av protoner (faktisk er den litt større).
Ikke stopp nå... Det er mer etter annonseringen;)
Kjernens diameter avhenger av mengden protoner og nøytroner som atomet har, men i gjennomsnitt er det rundt 10-14 måned 10-15 m.
Atomkjernen konsentrerer praktisk talt hele massen av atomet, og er en veldig liten del: både proton og nøytron er omtrent 100.000 ganger mindre enn hele atomet! Som sammenligning, forestill deg at vi forstørrer kjernen til atomet til grunnstoffet hydrogen (som bare har et proton) til størrelsen på en tennisball, ville det nærmeste elektronet være omtrent tre kilometer fra avstand! Selv om et atom ble forstørret til høyden på en bygning på 14 etasjer, ville kjernen være på størrelse med et saltkorn i 7. etasje. Det er virkelig noe fantastisk, tror du ikke ?!
* Elektrosfæren: Er region der elektroner roterer rundt kjernen. Til tross for å være et område med mye større volum enn kjernen, er det praktisk talt tomt, ettersom hvert elektron er 1836 ganger mindre enn 1 proton (eller enn 1 nøytron). Derfor er atommassen praktisk talt alt i kjernen. Elektroner er partikler med negativ elektrisk ladning (-1).
Elektroner ble oppdaget i 1897 av Joseph John Thomson (1856-1940), skaperen av Thomson atommodell. Thomsons eksperiment kan sees i detalj i teksten Thomsons eksperiment med elektriske utladninger, men kort sagt, han brukte nevnte Crookes ampulle og innså at katodestråler alltid var tiltrukket av den positive polen, som beviste at atomet hadde negative partikler, som ble kalt elektroner.
Elektroner snurrer rundt kjernen milliarder ganger per milliontedel av et sekund, former atomet og får det til å oppføre seg som om det var solid.
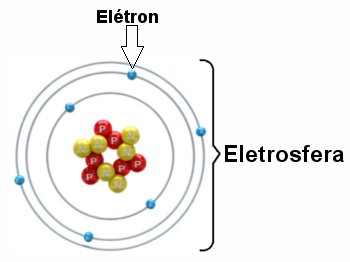
Illustrasjon av en elektrosfære med tre elektroniske lag og elektroner som roterer rundt kjernen.
Kort fortalt kan vi lage en tabell for å skille mellom de tre viktigste subatomære partiklene som er en del av atomets struktur:

Masse og elektrisk ladning av de tre viktigste subatomære partiklene - protoner, nøytroner og elektroner
Atomene til alle kjemiske elementene er sammensatt av disse tre subatomære partiklene. Det som skiller ett kjemisk element fra et annet er mengden som disse partiklene vises i, spesielt mengden protoner i kjernen, som kalles atomnummeret. Fortsett å studere om det gjennom teksten. Kjemisk element.
* Mind Map av meg. Diogo Lopes
Av Jennifer Fogaça
Uteksamen i kjemi
Kjemi
Klassifisering av materie, vann, hydrocyanic gass, karbondioksid, ammoniakk, hydrogen, helium, stoffer enkle, sammensatte stoffer, blandinger, faser av en blanding, homogen blanding, blanding heterogen.


