Spørsmål om kjemiske balanser i Enem er veldig tilbakevendende. Med dette i bakhodet opprettet vi dette materialet, som bringer de viktigste emnene om denne grenen av fysisk kjemi som dekkes i National High School Exam (Enem).
Blant problemene knyttet til kjemisk likevekt, har vi likevektskonstant når det gjelder konsentrasjon i mol / L og når det gjelder trykk, ionisk likevektskonstant, ioniseringskonstant, likevektsskift, pH og pOH, hydrolysekonstant, buffer og konstant av løselighet.
Blant emnene som er beskrevet ovenfor, får noen av dem større fremtredende plass i Enem:
Balanseskift
Ioniseringskonstant
pH
saltvannshydrolyse
Videoleksjon om Chemical Balance at Enem
1. Likevektsskifte i Enem
1.1- (Enem 2015) Hypoksi eller høydesyke består av redusert oksygen (O2) i kroppens arterielle blod. Av denne grunn opplever mange idrettsutøvere ubehag (hodepine, svimmelhet, kortpustethet) når de trener fysisk aktivitet i høye høyder. Under disse forholdene vil det være en reduksjon i konsentrasjonen av oksygenert hemoglobin (HbO2) i balanse i blodet, i henhold til forholdet:
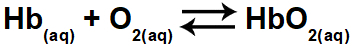
Endringen i konsentrasjonen av oksygenert hemoglobin i blodet skjer på grunn av:
a) forhøyet blodtrykk.
b) økningen i kroppstemperatur.
c) redusere temperaturen i miljøet.
d) fallet i oksygenpartialtrykk.
e) reduksjonen i mengden røde blodlegemer.
Oksygenert hemoglobin (HbO2) finnes i reaktantene (høyre side) av ligningen. Øvelsen spør hvilke av alternativene som vil føre til en endring i oksygenert hemoglobin i blodet, det vil si at det vil forandre balansen til venstre eller til høyre.
a) Falske. Økt blodstrøm har ikke noe med økt blodtrykk å gjøre.
b) Falske. Temperaturen endrer ikke balansen som tilbys.
c) Falske. Temperaturen endrer ikke balansen som tilbys.
d) Sant. Å redusere partielt oksygentrykk reduserer mengden oksygenert hemoglobin, og flytter balansen til venstre.
e) Falske. Fallet i antall røde blodlegemer vil føre til at både antall hemoglobiner og oksygenholdige hemoglobiner faller.
1.2- (Enem 2011) Brus har blitt flere og flere mål for folkehelsepolitikken. Limprodukter inneholder fosforsyre, et stoff som er skadelig for fiksering av kalsium, et mineral som er hovedkomponenten i tannmatrisen. Karies er en dynamisk prosess med ubalanse i prosessen med dental demineralisering, tap av mineraler på grunn av surhet. Det er kjent at hovedkomponenten i tannemaljen er et salt som kalles hydroksyapatitt. Brusen, ved tilstedeværelse av sukrose, senker pH i biofilmen (bakteriell plakk), forårsaker demineralisering av tannemaljen. Spyttforsvarsmekanismer tar 20 minutter til 30 minutter å normalisere pH-nivået, og remineralisere tannen. Følgende kjemiske ligning representerer denne prosessen:

Tatt i betraktning at en person bruker brus daglig, kan en prosess med tannavmineralisering forekomme som et resultat av den økte konsentrasjonen av:
a) OH-, som reagerer med Ca-ioner2+, skiftende balanse til høyre.
b) H+, som reagerer med OH-hydroksylene-, skiftende balanse til høyre.
c) OH-, som reagerer med Ca-ioner2+, skiftende balanse til venstre.
d) H+, som reagerer med OH-hydroksylene-, skiftende balanse til venstre.
e) Ca2+, som reagerer med OH-hydroksylene-, skiftende balanse til venstre.
Riktig svar: Bokstav B
Vedtak
Demineraliseringsprosessen skifter balansen til høyre. Når personen drikker brus, inntar de et surt materiale, det vil si å øke mengden H+ i midten. H+ interagerer raskt med OH- av likevekt, og reduserer mengden OH-. På denne måten blir balansen forskjøvet til høyre, og demineraliserer tannen.
1.3- (Enem-2013) Et av trinnene i vannbehandling er desinfisering, med klorering som den mest brukte metoden. Denne metoden består i å oppløse klorgass i en løsning under trykk og påføre den på vannet som skal desinfiseres. De kjemiske reaksjonsligningene som er involvert er:

Desinfiseringsvirkningen styres av hypoklorsyre, som har et desinfiseringspotensial omtrent 80 ganger større enn hypoklorittanionet. Mediumets pH er viktig fordi det påvirker i hvilken grad hypoklorsyre ioniserer. For at desinfeksjonen skal være mer effektiv, må pH i vannet som skal behandles være nærmere:
a) 0
b) 5
c) 7
d) 9
e) 14
Riktig svar: Bokstav B
I følge teksten utføres den beste desinfiserende handlingen av stoffet HClO. Derfor må enhver tolkning og konklusjon rettes mot en måte å få dette stoffet på.
Stoffet HClO er tilstede i den andre saldoen, så en interessant taktikk er å flytte denne balansen til venstre. For dette, ifølge prinsippet til Le Chatelier, har vi muligheten til å øke mengden H+ (tilsette et surt stoff, pH mindre enn 7) eller øke mengden Cl-.
Det er bemerkelsesverdig at det i den første ligningen er en annen kjemisk likevekt som presenterer HClO-arten-, som har tilknytning til H+, skiftende balanse til venstre. Dette er et grep vi ikke ønsker.
Derfor må vi bruke en sur pH (under 7). Imidlertid bør denne pH ikke være for sur til å unngå mange H-kationer.+ i midten.
Se også:Kjemisk balanse i huler
2. pH og saltvannshydrolyse i Enem
2.1- (Enem-2017) Flere naturlige produkter kan fås fra planter gjennom ekstraksjonsprosessen. Lapachol er av naftokinon-klassen. Dens struktur har en enolhydroksyl (pKa = 6,0) som gjør at denne forbindelsen kan isoleres fra ipe sagflis ved ekstraksjon med en tilstrekkelig løsning, etterfulgt av enkel filtrering. Tenk på at pKa = -log Ka og at Ka er syrekonstanten i lapacholioniseringsreaksjonen.

Hvilken løsning bør brukes til å ekstrahere lapachol fra ipê sagflis mer effektivt?
a) Na-løsning2CO3 for å danne et lapacholsalt.
b) Eddiksyre / natriumacetatbufferløsning (pH = 4,5).
c) NaCl-løsning for å øke ionestyrken til mediet.
d) Na-løsning2KUN4 for å danne et ionepar med lapachol.
e) HCI-løsning for å ekstrahere den ved hjelp av en syre-base-reaksjon.
Uttalelsen indikerer at stoffets pKa er 6,0. Denne pKa-verdien må brukes i pKa-uttrykket:
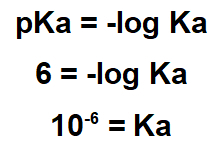
Siden Ka er liten, er lapachol et surt stoff, så det er nyttig å bruke et grunnleggende stoff for å fjerne det.
En sannhet. Salt er grunnleggende, siden det kommer fra en sterk base (fordi det er fra IA-familien), og CO3 kommer fra en svak syre (H2CO3).
b) Falske. Bufferløsningen er sur, og vi trenger en base.
c) Falske. NaCl er et nøytralt salt, da det kommer fra en sterk base (fordi det er fra IA-familien), og Cl kommer fra en sterk syre (HCl).
d) Falske. På2KUN4 er et nøytralt salt, ettersom Na kommer fra en sterk base (fordi det er fra IA-familien), og SO4 kommer fra en sterk syre (H2KUN4).
det er falskt. HCl er en syre, og vi trenger en base.
2.2- (Enem- 2014) Med sikte på å minimere miljøpåvirkninger fastslår brasiliansk lovgivning at kjemiske rester som slippes ut direkte i mottakerlegemet har en pH mellom 5,0 og 9,0. Et vandig flytende avfall generert i en industriell prosess har en hydroksylionkonsentrasjon lik 1.0.10-10 mol / L. For å overholde lovgivningen separerte en kjemiker følgende stoffer, tilgjengelig på selskapets lager: CH3COOH, Na2SO4, CH3OH, K2CO3 og NH4Cl.
Ikke stopp nå... Det er mer etter annonseringen;)
Hvilket stoff kan brukes til å justere pH-verdien for at resten skal frigjøres direkte i det mottakende legemet?
a) CH3COOH
b) I2KUN4
c) CH3Åh
d) K2CO3
e) NH4Cl
Riktig svar: Bokstav D
Vedtak
Trinn 1: Bestem pH på resten.
Øvelsen indikerer at resten har en hydroksydkonsentrasjon lik 10-10.
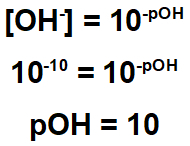
Derfor kan vi beregne pH-verdien til denne resten:

Fra ovenstående har vi at resten har en sur karakter, siden pH er mindre enn 7. For å nøytralisere det, er det derfor viktig å bruke et stoff med grunnleggende karakter.
Steg 2: Bestem karakteren til hvert salt for å indikere hvilken som er grunnleggende, som CH3COOH (alternativ a) er en syre, og CH3OH (alternativ c) er en alkohol, organisk klasse med sur karakter.
b) Nøytralt salt, da Na kommer fra en sterk base (fordi den er fra IA-familien), og SO4 kommer fra en sterk syre (H2KUN4).
d) Basissalt, ettersom K kommer fra en sterk base (fordi det er fra IA-familien), og CO3 kommer fra en svak syre (H2CO3).
e) Syresalt, som NH4 kommer fra en svak base (NH4OH), og Cl kommer fra en sterk syre (HCl).
2.3- (Enem- 2014) En forsker merker at etiketten på en av glassene der han holder et konsentrat av fordøyelsesenzymer, er uleselig. Han vet ikke hvilket enzym glasset inneholder, men mistenker at det er en gastrisk protease, som fungerer i magen ved å fordøye protein. Å vite at fordøyelsen i magen er sur og tarmen er grunnleggende, og han monterer fem prøverør med mat forskjellig, tilsett enzymkonsentratet til oppløsninger med en bestemt pH og vent på om enzymet virker i noe deres. Testrøret der enzymet må virke for å indikere at forskerens hypotese er riktig, er den som inneholder:
a) potetterning i oppløsning med pH = 9.
b) kjøttstykke i oppløsning med pH = 5.
c) kokt eggehvite i oppløsning med pH = 9.
d) porsjon nudler i oppløsning med pH = 5.
e) smørkule i oppløsning med pH = 9.
Riktig svar: Bokstav B
Øvelsen krever fra studenten god tolkning og korrelasjon med biokjemisk kunnskap om mat. Han informerer om at forskeren mener at enzymet er fordøyelsessystemet, virker ved en sur pH og virker på proteiner (fordi det er en protease).
Hvis dette enzymet virker i et surt miljø, må pH være mindre enn 7. Kjøtt består av proteiner, mens pasta består av karbohydrater. Så det rette svaret er alternativ b.
2.4- (Enem- 2012) En husmor dro ved et uhell vann fra avrimingen av en fisk i kjøleskapet, som etterlot en sterk og ubehagelig lukt inne i apparatet. Det er kjent at fiskens karakteristiske lukt skyldes aminer, og at disse forbindelsene oppfører seg som baser. I tabellen er hydrogenkonsentrasjonene av noen materialer som finnes på kjøkkenet oppført, som husmor tenker å bruke når hun rengjør kjøleskapet.

Blant materialene som er oppført, hvilke er passende for å lindre denne lukten?
a) Alkohol eller såpe
b) Sitronsaft eller alkohol
c) Sitronsaft eller eddik
d) Sitronsaft, melk eller såpe
e) Såpe eller brus / brus
Riktig svar: Bokstav C
Vedtak
Øvelsen foreslår en problematisk situasjon der en husmor kjøleskap har sterk lukt forårsaket av et stoff av grunnleggende natur. Dermed blir det stilt spørsmål ved hvilke materialer som vil være interessante å løse dette problemet.
For å nøytralisere en base, er det nødvendig å bruke et surt materiale eller med en pH lavere enn 7. Hvordan trening ga verdiene av H-konsentrasjoner+ av materialene var det nok å bruke hver av dem i uttrykket nedenfor:

Og dermed:
Saft: pH = 2
Melk: pH = 6
Eddik: pH = 3
Alkohol: pH = 8
Såpe: pH = 12
Tønne: pH = 12
Materialer med sur karakter er juice, eddik og melk. Således er det bare alternativ c som gir materialer av sur karakter.
3. Likevektskonstant i Enem
3.1- (Enem-2016) Etter fullstendig slitasje kan dekkene brennes for kraftproduksjon. Blant gassene som genereres ved fullstendig forbrenning av vulkanisert gummi, er noen forurensende stoffer og forårsaker surt regn. For å forhindre at de rømmer ut i atmosfæren, kan disse gassene bobles inn i en vandig løsning som inneholder et passende stoff. Vurder stoffinformasjonen som er oppført i tabellen nedenfor:

Blant stoffene som er oppført i tabellen, er den som effektivt kan fjerne forurensende gasser (a)
a) fenol.
b) pyridin.
c) metylamin.
d) kaliumhydrogenfosfat.
e) kaliumhydrogensulfat.
Riktig svar: Bokstav D
Vedtak
Øvelsen utgjør en problematisk situasjon der forurensende gasser fremmer surt regn. Deretter spør han hvilke av de nevnte stoffene som vil være interessante å nøytralisere disse gassene og følgelig unngå surt regn.
For å unngå surt regn må syregasser nøytraliseres ved hjelp av en basisk løsning. Stoffer med denne karakteristikken er de som fortrinnsvis frigjør OH-grupper- i midten. I tabellen er pyridin, metylamin og kaliumhydrogenfosfat basiske stoffer.
For å bestemme stoffet som er i stand til å fjerne forurensende gasser mer effektivt, må vi analysere verdien av ioniseringskonstanten. Jo større konstant, jo større er muligheten til å frigjøre OH-. Så kaliumhydrogenfosfat det er det mest egnede stoffet i dette tilfellet.
3.2- (Enem-2015) Flere syrer brukes i næringer som avhender avløpet i vannforekomster, som elver og innsjøer, noe som kan påvirke miljøbalansen. For å nøytralisere surheten, kan kalsiumkarbonatsalt tilsettes utløpet i passende mengder, da det produserer bikarbonat, som nøytraliserer vannet. Ligningene som er involvert i prosessen presenteres:

Basert på verdiene til likevektskonstantene i reaksjonene II, III og IV, ved 25O C, hva er den numeriske verdien av likevektskonstanten for reaksjon I?
a) 4,5x10-26
b) 5x10-5
c) 0,8x10-9
d) 0,2x105
e) 2.2x1026
Riktig svar: Bokstav B
Vedtak
Denne øvelsen innebærer konstant ionisering. I utgangspunktet er det viktig å forstå at ligning I faktisk er resultatet (summen) av ligningene II, III og IV. Derfor, for å starte oppløsningen, må vi bruke prinsippene for hess lov.
Trinn 1: Bruk av Hess 'lov.
Inverterende ligning II og opprettholdelse av ligning III og IV har vi:
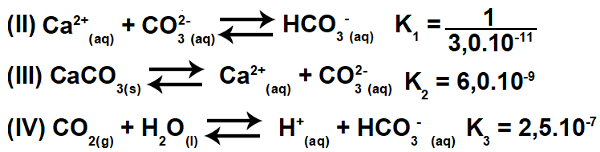
Dermed kan vi observere at anionen CO3-2 og H-kationen+ vil bli eliminert, og summen av ligningene vil resultere i ligning I.
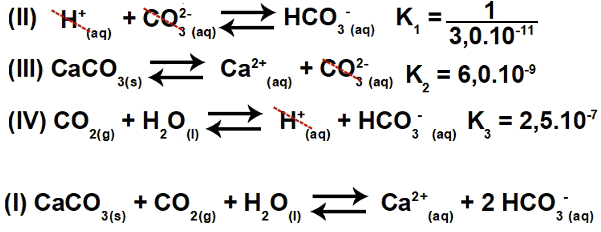
Steg 2: konstant beregning
Likevektskonstanten til ioniseringsligningen gis alltid ved å multiplisere konstantene til de andre ligningene:

Av meg. Diogo Dias