Ether det er en oksygenert organisk funksjon, det vil si at den har det kjemiske elementet oksygen, i tillegg til karbon og hydrogen. Denne funksjonen har som hovedkonstruksjonskarakteristikk tilstedeværelsen av to organiske radikaler festet til et oksygenatom.
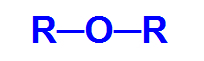
Generell strukturformel for en eter
Således er karbonkjeden til en eter heterogen og kan ha to identiske eller forskjellige radikaler, enten alkyl, typer radikaler som ikke har aromatisk struktur, eller aryl, radikaler som ikke har struktur aromatisk.
Fysiske egenskaper ved eter
Når det gjelder den fysiske tilstanden ved romtemperatur: når eter den har fire eller flere karbonatomer i sammensetningen, den er flytende;
Når det gjelder smeltepunkt og kokepunkt: sammenlignet med andre masseorganiske forbindelser tilnærmet molar, har et smeltepunkt som ligner det for alkaner og lavere enn resten av forbindelsene organisk;
Når det gjelder tetthet: de er forbindelser som har en liten tetthet sammenlignet med vann;
Når det gjelder samhandlingskreftene: etrene er sammensatt med lav polaritet, samhandler med hverandre gjennom en svak permanent dipolinteraksjon. Med vann og alkoholer har etere evnen til å samhandle gjennom hydrogenbindinger.
Når det gjelder polaritet: er forbindelser som har vinkelgeometri, og derfor er de polare.
Når det gjelder den organoleptiske egenskapen: Dette er stoffer som gir en veldig behagelig lukt, men innånding kan forårsake avhengighet.
Offisiell nomenklatur for eteren
Mindre stamme prefiks + oxy + major stamme prefiks + infix + o
Å gjennomføre den offisielle nomenklaturen til a eter, Det er viktig å bestemme hvilken som er din viktigste ligand og hvilken som er din mindre ligand. For å gjøre det, følg to eksempler på søknad om denne navngivningsregelen nedenfor:
Første eksempel:
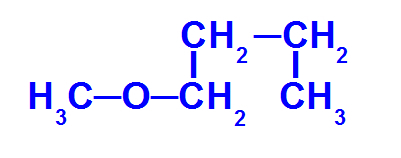
Strukturformel av en eter med færre karbonatomer
Eteren ovenfor har følgende radikaler:
Metyl (CH3-);
Butyl (CH3-CH2-CH2-CH2-).
For å navngi denne forbindelsen har vi:
mindre radikal prefiks: Met
+
oxy
+
hovedstamme prefiks: men
+
en (fordi den bare har enkle lenker)
+
O
Så navnet på dette eter det vil være metoksybutan.
Andre eksempel:
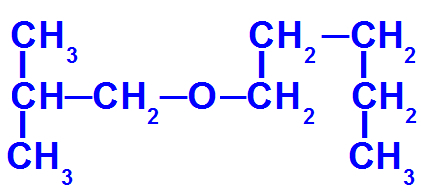
Strukturformel av en eter med flere karbonatomer
Denne eteren har følgende radikaler:
Isobutyl [(CH3)2-CH-CH2-);
pentyl (CH3-CH2-CH2-CH2-CH2).
For å nevne det har vi derfor:
mindre radikalt prefiks: isobut
+
oxy
+
hovedstamme prefiks: pent
+
en (fordi den bare har enkle lenker)
+
O
Dermed navnet på eter i spørsmålet vil være isobutoksypentan.
Vanlig eternomenklatur
Ether + navn på radikaler (enkleste og da mest komplekse) + ico
eller
Radikale navn + eter
Følg nedenfor to eksempler på søknad for denne navngivningsregelen:
Første eksempel:

Strukturformel for en eter som har fire karbonatomer
At eter presenterer følgende radikaler:
Metyl (CH3);
Isopropyl (CH3-CH-CH3).
Så for denne forbindelsen har vi:
Ether
+
mindre radikal: metyl
+
større radikale prefiks: isopropyl
+
jeg
Dermed navnet på eter i spørsmålet vil være metylisopropyleter, ellers vil metylisopropyleter være.
Andre eksempel:

Strukturformel for en eter som har fem karbonatomer
Eteren ovenfor har følgende radikaler:
Etyl (CH3-CH2-);
Propyl (CH3-CH2-CH2-).
For å navngi denne forbindelsen har vi:
Ether
+
mindre radikal: etyl
+
større radikale prefiks: propyl
+
jeg
Dermed navnet på eter i spørsmålet vil være etylpropyleter, som også kan være etylpropyleter.
Bruk av etere
Generelt brukes etere:
Som inerte organiske løsningsmidler, det vil si ikke delta i noen reaksjon;
Brukes til utvinning av essenser, som blomster, tre osv .;
Brukes i ekstraksjon av forskjellige oljer og fett.
Av meg. Diogo Lopes
Kilde: Brasilskolen - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-eter.htm