Vi er omgitt av utstyr som, for å fungere, trenger celler eller batterier. Imidlertid blir mange av disse bærbare enhetene mindre og med det kommer det store behovet for miniatyrbatterier.
Et eksempel på denne typen batterier er kvikksølv eller også kalt kvikksølv-sinkbunke.
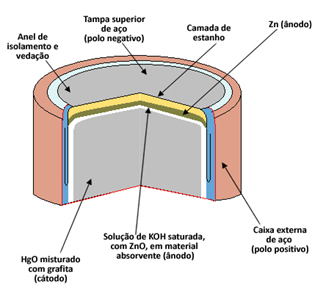
Hver celle består av to elektroder, anoden (negativ pol) og katoden (positiv pol), og en elektrolytt. Når det gjelder kvikksølvcellen, er anode er dannet av en kapsel av metallisk sink (Zn(s)) det er katode per kvikksølvoksid II (HgO(s)). Både Zn og HgO blir malt til pulver og komprimert for å gjøre bunken så liten som mulig. O elektrolytt er laget av en løsning av mettet kaliumhydroksid (KOH(her)).
Zn oksyderer og donerer elektronene til HgO, som vist i halvreaksjonene og den globale reaksjonen til denne cellen nedenfor:
Anode Halvreaksjon: Zn(s) + 2 OH1-(her) → ZnO(s) + 2 H2O(1) + 2e-
Katode-halvreaksjon: HgO(s) + H2O(1) + 2e- → Hg(1) + 2 OH1-(Deq)
Global reaksjon: HgO(s) + Zn(s) → ZnO(s) + Hg(1)
Kvikksølvceller brukes i digitale klokker, armbåndsur, kameraer, kalkulatorer, elektroniske arrangører, høreapparater og andre bærbare elektriske apparater som krever effektivt arbeid og holdbarhet, ettersom disse batteriene har spenning på 1,35V.

Dessverre kan feil kassering av disse batteriene utgjøre en alvorlig risiko for miljøet ettersom de inneholder kvikksølv, som er et tungmetall. Kvikksølv kan forurense jord, grunnvann, innsjø og elv og nå dyr og mennesker. Det er giftig selv i små mengder. Blant helseproblemene som kvikksølv kan forårsake er: skade på slimhinner, hud, nyrer, voldsom kvalme, oppkast, magesmerter, blodig diaré, og det kan føre til døden.
For å finne ut mer om hvorfor batterier er giftig avfall, hvordan kvikksølv er forurenset og hva vi skal gjøre med brukte batterier, kan du lese teksten sitert nedenfor.
Av Jennifer Fogaça
Uteksamen i kjemi
Kilde: Brasilskolen - https://brasilescola.uol.com.br/quimica/pilhas-mercurio.htm

