DE stereoisomerisme, også kjent som Romisomerisme, er en type isomerisme der dens isomerer er differensiert ved at båndene mellom atomene deres arrangeres forskjellig i rommet.
Det er to typer stereoisomerer, diastereoisomerer og enantiomerer. Diastereoisomerer er geometriske isomerer av cis-trans-typen, som ikke er speilbilder av hverandre, mens enantiomerer er optiske isomerer som er speilbilder av hverandre.
Snakker litt om cis-trans diastereoisomer, forekommer det bare i forbindelser som er umettede eller som er sykliske. Hvorfor forekommer det ikke i mettede kjedeforbindelser, det vil si som bare har enkeltbindinger mellom karbon?
Det kan skje at vi blir forvirrede og tenker at visse mettede forbindelser er diastereoisomerer, når de faktisk representerer den samme forbindelsen. For eksempel nedenfor har vi tre romlige konformasjoner av atomene til 1,2-dikloretan:
H H H H H Cl
│ │ │ │ │ │
H — Ç — Ç — H H — Ç — Ç — ClH — Ç — Ç — H
│ │ │ │ │ │
Cl ClCl H Cl H
Ikke stopp nå... Det er mer etter annonseringen;)
Er disse tre diastereoisomerer? Ikke. Faktisk, de tre molekylene er av samme forbindelse. Det som skjer er at enkeltbindinger eller sigma (σ) mellom karbon kan gjennomgå rotasjoner, noe som resulterer i forskjellige atomarrangementer.
Se hvordan dette skjer i skjemaet nedenfor med etan:

Disse forbindelsene, som faktisk er den samme forbindelsen, utfører ikke geometrisk cis-trans-isomerisme, men kalles konformasjonsisomerer, da de bare skiller seg i formen av deres atomer forårsaket av rotasjon rundt enkeltbindingen.
En av måtene å representere disse molekylene for å gjøre det enkelt å visualisere rotasjonen av tilkoblingsaksen er gjennom Newmans projeksjon, der det betraktes som om synsplanet var nøyaktig på aksen til båndet mellom karbonene, og de er representert av en sentral sirkel. Se Newmans projeksjon for etan:

Vi kan også representere disse forskjellige konformasjonene gjennom formel på staffelier:
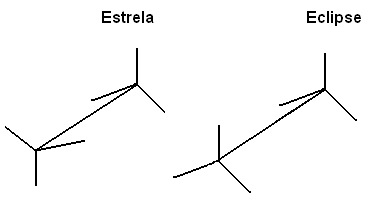
Denne frie rotasjonen av koblingsaksen forekommer ikke lenger i umettede forbindelser eller i sykliske. Tenk deg for eksempel at vi bygger en enkel modell, som representerer to karboner av to isoporkuler som er forbundet med en tannpirker som sitter fast i dem.
Når vi har en enkelt tannpirker og holder en av kulene, kan den andre lett rotere rundt sin egen akse, akkurat som det gjør med enkel binding.

Imidlertid, hvis vi plasserer en tannpirker til som forbinder de to kulene, vil vi ikke være i stand til å holde den ene kule og rotere den andre. Hvis vi gjør dette, vil tannpirkerne knekke. På samme måte, når det er en pi-binding og en sigma (dobbeltbinding), er det en hindring for rotasjonen av karbonene.
Derfor, i tilfellet nedenfor, der vi har en dobbeltbinding mellom karbonene, er det ikke snakk om to konformasjonsisomerer, det vil si to konformasjoner for det samme molekylet; vi har faktisk to cis-trans diastereoisomerer:
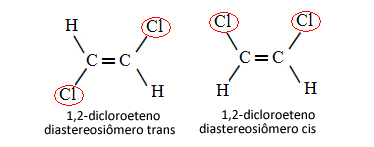
Se mer om denne typen isomerisme i teksten Geometriske eller cis-trans-isomerer.
Av Jennifer Fogaça
Uteksamen i kjemi
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
FOGAÇA, Jennifer Rocha Vargas. "Konformasjonsisomerisme"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/isomeria-conformacional.htm. Tilgang 28. juni 2021.



