De overgrote meerderheid van de materialen die in de natuur, in onze samenleving en in ons lichaam worden aangetroffen, zijn geen pure stoffen, maar in feite mengsels van twee of meer stoffen.
Hoewel we meestal naar mineraalwater verwijzen als "water", bevat het in werkelijkheid niet alleen de zuivere stof H2O, want het is het resultaat van een proces waarbij regenwater de bodem binnendringt en door verschillende rotsen gaat.
Dus, zoals de naam al aangeeft, bevat het naast water ook verschillende opgeloste mineralen. Als je nieuwsgierig bent naar het etiket van mineraalwater, zul je zien dat het in zijn samenstelling heeft scheikunde strontium sulfaten, calcium, natrium, kalium, natriumbicarbonaat, natriumfluoride, onder anderen.
Mindmap: mengsels
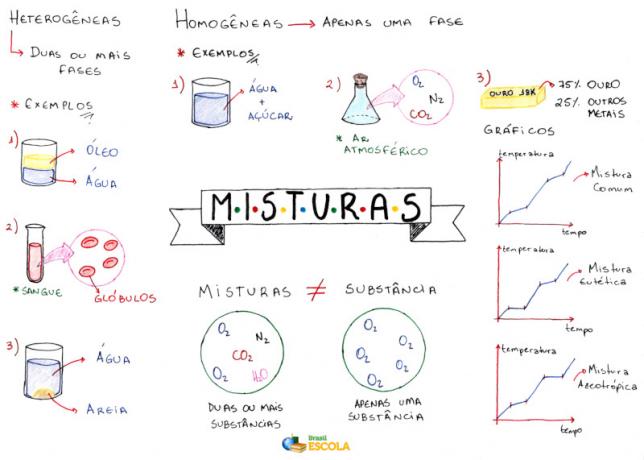
* Om de mindmap in PDF te downloaden, Klik hier!
Hoe is het mogelijk om een stof van een mengsel te onderscheiden?
Het hieronder getoonde gedestilleerde water is een zuivere stof die alleen H. bevat2O:

Gedestilleerd water gebruikt in laboratorium
Visueel ziet het er precies uit als een mengsel van water en zout; ze kunnen echter worden onderscheiden van de blenddefinitie. Kijken:
→ mengsels zijn materialen waarvan de fysieke eigenschappen niet constant zijn, maar variëren bij een bepaalde temperatuur en druk.
Meet dus gewoon de fysieke eigenschappen, zoals smelt- en kookpunten en dichtheid. Als ze constant en goed gedefinieerd zijn, is het a pure substantie (in het geval van gedestilleerd water, bij 4°C, is de dichtheid 1,0 g/cm3 en op zeeniveau zijn de smelt- en kookpunten respectievelijk 0°C en 100°C).
Niet stoppen nu... Er is meer na de reclame ;)
Als er echter variaties worden gepresenteerd, is het een mengsel. Als je het water-zoutmengsel verwarmt om het kookpunt te controleren, zul je zien dat tijdens de overgang van vloeibare toestand naar gas, de temperatuur blijft niet constant, zoals bij gedestilleerd water, dat op 100 °C blijft totdat alle vloeistof verandert stoom.
Nu zijn er mengsels dat het niet eens nodig is om hun fysische eigenschappen te bepalen om te weten dat het mengsels zijn, kijk maar, zoals het geval is met het volgende mengsel van water en olie:

Mengsel gevormd door water en olie
Dit geeft aan dat er verschillende soorten mengsels zijn, die kunnen worden ingedeeld in: homogeen en heterogeen. Zie elk:
Homogene mengsels:
Het zijn degenen die een uniform uiterlijk hebben, met een enkele fase (enkele fase). Voorbeelden:
zoutoplossing (0,9 g natriumchloride in 100 ml water);
pekel (36 g zouten zoals natriumchloride, magnesiumchloride, kaliumjodaat, anti-humectanten en 100 ml water);
gehydrateerde alcohol (ethanol en water);
lucht (78% stikstofgas, 20% zuurstofgas, 2% overige gassen en waterdamp);
staal (metaallegering gevormd door 98,5% ijzer en 1,5% koolstof).

Zoutoplossing, staal en formaldehyde, voorbeelden van homogene mengsels
De bovenstaande voorbeelden laten zien dat: homogene mengsels ze kunnen in vaste, vloeibare of gasvormige toestand zijn. Deze homogene mengsels worden genoemd oplossingen en ze kunnen niet worden gescheiden door fysieke methoden, maar alleen door chemische technieken. Om bijvoorbeeld alcohol van water te scheiden, is het noodzakelijk om een proces uit te voeren van: distillatie, omdat een centrifugeren of filtratie het zou niet doen.
Daarnaast is het belangrijk om te benadrukken dat ze moeten homogeen zelfs als u onder een ultramicroscoop kijkt. Met het blote oog kunnen melk en bloed er bijvoorbeeld homogeen uitzien, maar onder de ultramicroscoop zien we dat ze in werkelijkheid heterogeen. Bekijk het beeld van het bloed onder de ultramicroscoop en zijn afzonderlijke fasen nadat het in een ultracentrifuge is geplaatst:
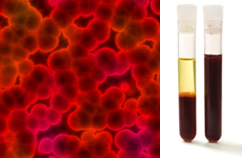
Microscopisch beeld en bloedfasen
Heterogene mengsels:
Zijn degenen die meer dan één fase hebben. Voorbeelden: water en olie, water en zand, ijs en water, graniet, water en ijzer, onopgelost zout in water, enz.
De componenten van heterogene mengsels ze verschijnen in de meeste gevallen in verschillende fysieke toestanden en kunnen worden gescheiden door fysieke methoden. Een voorbeeld doet zich voor wanneer we koffie zetten en de vaste stof filteren en deze van de vloeistof scheiden.
Maar dit gebeurt niet altijd, zoals blijkt uit het geval van olie en water, die, ondanks dat het beide vloeistoffen zijn, niet oplossen vanwege verschillende polariteiten van zijn moleculen.
mentale kaart Door Moeder Victor Ricardo Ferreira
Scheikundeleraar
Door Jennifer Fogaça
Afgestudeerd in scheikunde