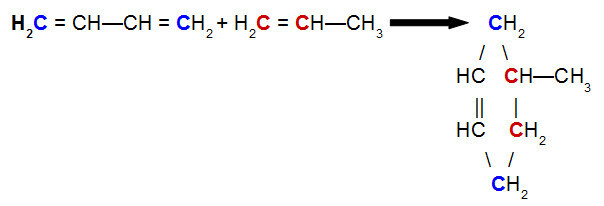Het koolstofatoom wordt als speciaal beschouwd vanwege zijn vermogen om bindingen te vormen met andere atomen en aanleiding te geven tot lange koolstofketens. Alles is te danken aan de tetravalentie van koolstof, het kan samenkomen en vier bindingen vormen, en de deelnemende atomen kunnen koolstof of andere elementen zijn. Deze laatste worden, indien aanwezig in de koolstofketen, heteroatomen genoemd.
De meest voorkomende heteroatomen zijn: Stikstof (N), Zuurstof, Zwavel (S) en Fosfor (P).
Voorbeeld:
Het zuurstofatoom dat in de bovenstaande keten aanwezig is, is een heteroatoom, net als tussen koolstofatomen.
Maar let op! Verwar vertakking niet met heteroatoomkoolstof, zie:
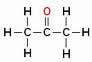
Het zuurstofatoom (in rood) bevindt zich niet tussen koolstofatomen maar erboven en vormt een vertakking, dus het kan niet als een heteroatoom worden beschouwd.
Classificatie van atomen in een koolstofketen:
In een keten wordt elke koolstof geclassificeerd op basis van het aantal andere koolstofatomen dat eraan vastzit.
primaire koolstof
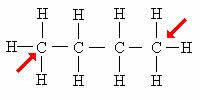
De pijl geeft de primaire koolstoffen aan. Merk op dat omdat ze zich aan de uiteinden van de koolstofketen bevinden, deze atomen slechts aan 1 koolstof binden.
secundaire koolstof: Direct gekoppeld aan 2 andere koolstoffen.

De aangegeven koolstofatomen bevinden zich tussen twee koolstofatomen.
tertiaire koolstof: Direct gekoppeld aan 3 andere koolstoffen.
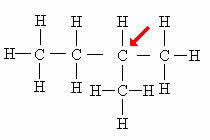
Merk op dat de aanwezigheid van de tak (CH3) gehecht aan het aangegeven atoom zorgt ervoor dat het de tertiaire koolstofclassificatie krijgt.
Quaternaire koolstof: Direct gekoppeld aan 4 andere koolstoffen.
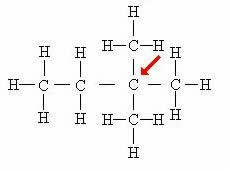
In dit geval vormen de vier atomen die aan het centrale koolstofatoom zijn bevestigd (aangegeven door de pijl) een soort "vierkant", wat de aanwezigheid van het quaternaire koolstof verder bewijst.
Niet stoppen nu... Er is meer na de reclame ;)
Door Liria Alves
Afgestudeerd in scheikunde
Brazilië School Team
Bekijk meer!
Classificatie van koolstofketens: soorten bindingen
Eigenschappen van organische verbindingen
Organische chemie - Chemie - Brazilië School
Wil je naar deze tekst verwijzen in een school- of academisch werk? Kijken:
SOUZA, Liria Alves de. "Het vermogen van organische verbindingen om ketens te vormen"; Brazilië School. Beschikbaar in: https://brasilescola.uol.com.br/quimica/capacidade-compostos-organicos-formar-cadeias.htm. Betreden op 28 juni 2021.
d) Koolstofatomen vormen gemakkelijk ionische bindingen.