De werking van een katalysator is in feite om de ontwikkeling van een bepaalde reactie te versnellen. Dit is mogelijk omdat de katalysator verandert het mechanisme waarmee de reactie verloopt, wat leidt tot een "alternatief pad" dat minder activeringsenergie vereist om de reactie te starten en het geactiveerde complex te bereiken.
Er zijn verschillende soorten katalyse, waaronder de heterogene katalyse, die kan worden gedefinieerd als dat wat optreedt wanneer het systeem meer dan één fase heeft, dat wil zeggen dat de reactanten en producten zich in een fysieke toestand bevinden die verschilt van de fysieke toestand van de katalysator.
Een voorbeeld dat we kunnen noemen is een tussenstadium van zwavelzuurvorming (H2ENKEL EN ALLEEN4(aq)). Deze stap bestaat uit de vorming van zwaveltrioxide (SO3(g)) door de verbrandingsreactie van zwaveldioxide (SO2(g)):
2 SO2(g) + O2(g) → 2 besturingssystemen3(g)
Omdat deze reactie zo langzaam verloopt, wordt een katalysator gebruikt om deze te versnellen. Een katalysator die in dit geval kan worden gebruikt is divanadiumpentoxide (V
2O5(S)), die stevig is. Omdat de reactanten en het reactieproduct gasvormig zijn, zullen we een heterogeen systeem hebben.Maar hoe kan divanadiumpentoxide de reactie versnellen?
Wat er gebeurt, is dat de moleculen van het zuurstofreagens worden geadsorbeerd, dat wil zeggen vastgehouden op het oppervlak van het divanadiumpentoxide. Dit zorgt ervoor dat de bindingen van de moleculen van dit gas na verloop van tijd verzwakken, wat de vorming van het complex vergemakkelijkt geactiveerd en, bijgevolg, vermindert de activeringsenergie van de reactie, waardoor de ontwikkelingssnelheid toeneemt, dat wil zeggen de snelheid.
Bekijk in onderstaand schema hoe dit gebeurt:
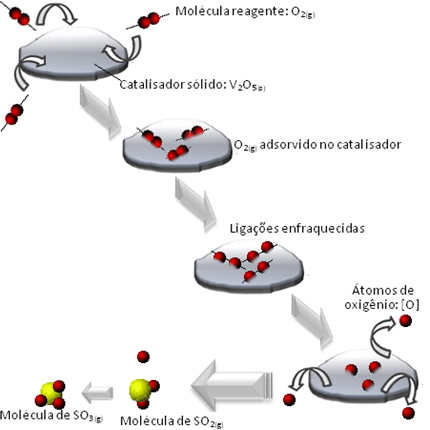
Andere voorbeelden van heterogene katalyse worden hieronder getoond. Merk op dat in beide gevallen de reactanten en producten zich in de gasvormige, waterige of vloeibare toestand bevinden, terwijl de katalysatoren in de vaste toestand zijn:
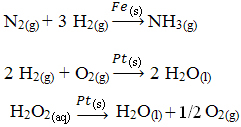
Een voorbeeld van heterogene katalyse die in ons dagelijks leven voorkomt, is die van converters auto katalysator, beter bekend als katalysatoren. Deze apparaten tegen vervuiling zijn gecoat met stoffen die als katalysator werken, meestal een legering van palladium en rhodium (voor benzinemotoren) en palladium en molybdeen (voor benzinemotoren). alcohol).
Binnen deze katalysator treden chemische reacties op waarbij gassen van onvolledige verbranding, die schadelijker zijn voor de mens, worden omgezet in niet-giftige gassen. Reagentia en producten zijn allemaal gassen, terwijl katalysatoren vaste stoffen zijn.
Lees de tekst voor meer informatie over het besturingssysteem van deze apparatuur: "Katalysator”.
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/catalise-heterogenea.htm

