Joseph Lous Gay-Lussac (1778-1850) was een wetenschapper die belangrijke studies van gassen maakte. Hij voerde de productie uit van water uit de reactie tussen waterstof- en zuurstofgassen en verifieerde dat ze: reageerde altijd in de verhouding van twee volumes waterstof tot één volume zuurstof, waarbij twee volumes. werden geproduceerd Water:
Waterstof + Zuurstof → Water
1e experiment: 2 L 1 L 2 L
2e experiment: 4 L 2 L 4 L
3e experiment: 8 L 4 L 8 L
4e experiment: 16 L 8 L 160 L
Merk op dat in alle experimenten de verhouding altijd hetzelfde is: 2: 1: 2.
Na verschillende experimenten en analyses, beseffend dat hetzelfde gebeurde met andere soorten reacties tussen gassen, dat wil zeggen de reacties altijd een constante volumeverhouding volgde, kwam deze wetenschapper tot de volgende wet van reacties in gasvormige volumes, bekend als: Volumetrische wet van Gay-Lussac of Wet van combinatie van volumes:

Verklaring van de volumetrische wet van Gay-Lussac
Maar deze wet was tegen de De atoomtheorie van Dalton
, die zei dat alles werd gevormd door massieve en ondeelbare bolvormige deeltjes, de atomen. Volgens deze theorie moet het volume van de producten in de reactie gelijk zijn aan de som van de volumes van de reactanten. Het volgende zou dus moeten gebeuren:Waterstof + Zuurstof → Water
2 delen + 1 deel → 3 delen
Maar Gay-Lussac toonde aan dat dit in de praktijk niet het geval was, het resultaat was gelijk aan twee volumes waterdamp.
Het antwoord op deze schijnbare tegenstrijdigheid kwam door de hypothese of Wet van Avogadrodro.

Stempel gedrukt in Italië toont Amedeo Avogadro en de verkondiging van zijn wet, in 1956*
Amedeo Avogadro (1776-1856) toonden aan dat gassen in werkelijkheid geen geïsoleerde atomen waren, maar moleculen (met uitzondering van de edelgassen). Zijn wet zei:

Wetsverklaring van Avogadrodro
Avogadro liet zien dat 1 mol van elk gas heeft 6.02. 1023 moleculen. Deze waarde staat bekend als Avogadro's getal of constante. Het is bewezen dat in de normale omstandigheden van temperatuur en druk (CNTP), waarin de druk gelijk is aan 1 atm en de temperatuur 273 K (0°C), het volume ingenomen door 1 mol van een gas zal altijd 22,4 L zijn. Deze waarde komt overeen met de molair volume van gassen. Deze relaties zijn erg belangrijk voor het oplossen van oefeningen van stoïchiometrie.
Dit lijkt misschien vreemd, aangezien de volgende vraag kan rijzen: hoe kunnen gassen met moleculen en atomen van verschillende grootte hetzelfde volume innemen?
Dit komt omdat de gasmoleculen zo ver uit elkaar liggen dat de grootte van de moleculen verwaarloosbaar is.
Op deze manier verklaarde de volumetrische wet van Avogadro de volumetrische wet van Gay-Lussac. Merk hieronder op dat twee waterstofmoleculen (twee volumes) reageren met één zuurstofmolecuul (één volume) om twee watermoleculen (twee volumes) te vormen. Water en waterstof hebben hetzelfde volume omdat ze dezelfde hoeveelheid moleculen hebben, zoals aangegeven door de wet van Avogadro.
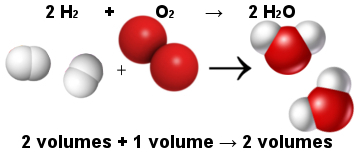
Verhouding tussen moleculen in de watervormingsreactie
Tegelijkertijd zorgde de wet van Avogadro ervoor dat de atoomtheorie stand hield, aangezien je ziet dat er in zowel reactanten als producten in totaal 6 atomen zijn (4 waterstof en 2 zuurstof).
Deze volumetrische wetten waren erg belangrijk voor de ontwikkeling van het concept van moleculen.
* Afbeelding auteursrechtelijk beschermd: rook76 / Shutterstock.com
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/lei-volumetrica-gay-lussac.htm