Volgens de Franse chemicus Henry Louis Le Chatelier, evenwichtsverschuiving het is een situatie waarin een chemische reactie wordt verschoven (vooruit of achteruit) wanneer deze wordt blootgesteld aan een externe verstoring. Deze door de chemicus voorgestelde verklaring werd bekend als: principe van Le Chatelier.
Opmerking: directe reactie is die waarin de reactanten worden omgezet in producten, terwijl de inverse reactie degene is waarin de producten worden omgezet in reactanten.
Een reactie is in evenwicht wanneer de snelheid van de directe reactie hetzelfde is als de omgekeerde reactie, dat wil zeggen, de reactanten veranderen in producten met dezelfde snelheid als producten in reactanten veranderen.

Algemene weergave van een chemische evenwichtsreactie
Volgens het principe van Le Chatelier geldt dat wanneer een kracht op een evenwichtsreactie inwerkt, de evenwichtsverschuiving het zal plaatsvinden om deze verstoring teniet te doen en een nieuwe evenwichtssituatie in de reactie tot stand te brengen.
De verstoringen die in staat zijn om een chemisch evenwicht verschuiven zij zijn:
→ concentratie variatie
wanneer de concentratie in hoeveelheid materie (in mol/L of molair) van een deelnemer aan de reactie is veranderd (verlaagd of verhoogd), de balans verschuiving, zolang die deelnemer zich niet in vaste toestand bevindt.
Dus, volgens het principe van Le Chatelier, als de concentratie als een deelnemer wordt verhoogd, verschuift de balans in de tegenovergestelde richting van de toename. Als de concentratie de deelnemer wordt verminderd, zal er een verplaatsing van de balans in de richting van de daling zijn. Bijvoorbeeld:

Algemene weergave van een chemische evenwichtsreactie
Verhogen van de concentratie van A = balans verschuift naar rechts
De concentratie van B verlagen = de balans verschuift naar links
→ Variatie van druk
De drukvariatie bevordert alleen verschuiving in evenwicht die gasvormige componenten hebben, want wanneer het wordt verhoogd, vergroten de moleculen de botsingen met elkaar, en wanneer de druk wordt verlaagd, verminderen ze de botsingen met elkaar.
De botsingen tussen moleculen nemen toe met toenemende druk, omdat het volume (ruimte) dienovereenkomstig wordt verlaagd, terwijl de druk gaat gepaard met een toenemend volume.
Opmerking: In een chemisch evenwicht houdt de analyse van het effect van drukmodificatie rekening met het molaire volume van reactanten en producten, welk volume gerelateerd is aan de reactiecoëfficiënten. In de onderstaande vergelijking is het reagensvolume 4 en het product 2.
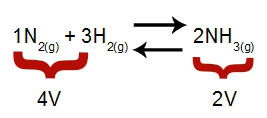
Vergelijking die de volumes aangeeft die aanwezig zijn bij de vorming van ammoniak
Volgens het principe van Le Chatelier geldt dat als de druk van een systeem wordt verhoogd, de verplaatsing van de balans in de richting van groter volume, terwijl als de druk wordt verlaagd, de verplaatsing van de balans.

Vergelijking die de balans van ammoniakvorming weergeeft
Toenemende druk = balans verschuift naar rechts (omdat het de kant is met minder volume).
Afnemende druk = balans verschuift naar links (omdat dit de hogere volumezijde is).
→ Temperatuurvariatie
de toename van temperatuur- van een evenwichtsreactie begunstigt de moleculen om meer te botsen, terwijl de afname van temperatuura vermindert hun opwinding en bijgevolg hun schokken. Omdat de temperatuurstijging altijd een reactie bevordert, endotherm (een die energie absorbeert).
De analyse van het effect van temperatuur op een evenwicht houdt voornamelijk rekening met de ΔH van de reactie. Als ΔH positief is, zal de voorwaartse reactie endotherm zijn, terwijl de omgekeerde exotherm zal zijn. Als de ΔH negatief is, is de rechter exotherm en de inverse endotherm.
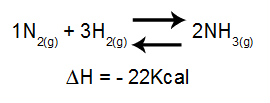
Vergelijking met enthalpievariatie in ammoniakvorming
Toenemende temperatuur = evenwicht verschuift naar links (omdat dit de richting is van de endotherme reactie, aangezien ΔH negatief is).
Dalende temperatuur = evenwicht verschuift naar rechts (omdat dit de richting is van de exotherme reactie, aangezien ΔH negatief is).
Door mij Diogo Lopes Dias
Bron: Brazilië School - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-deslocamento-equilibrio.htm

