Aangezien er duizenden organische verbindingen zijn, kan het fenomeen isomerie verschillende vormen aannemen. Daarom kan isomerie in principe in twee soorten worden ingedeeld: platte of constitutionele isomerie en ruimte-isomerie of stereo-isomerie. Elk genoemd type kan worden onderverdeeld, zoals weergegeven in het volgende schema:
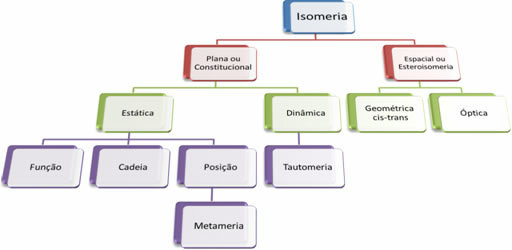
Zie elk geval:
1. Vlak of constitutioneel isomerie: Isomeren van dit type hebben dezelfde molecuulformule en onderscheiden zich door platte structuurformules. Er zijn vijf gevallen van vlakke isomerie: functie, ketting, positie, metamerie en tautomerie.
1.1.Functionele of functionele isomerie: Het verschil tussen de isomeren zit in de functionele groep.
Voorbeeld: Molecuulformule C3H6O
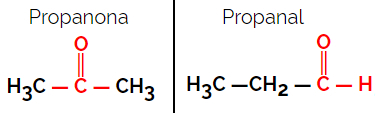
Merk op dat propanon van de ketongroep is en propanal van de aldehydegroep.
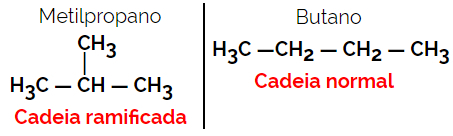
1.2. Keten- of skeletisomeren: Het verschil tussen de isomeren zit in het type keten. Een isomeer is bijvoorbeeld een open keten en de andere een gesloten keten, of de ene is een normale keten en de andere vertakte keten, of de ene is een homogene keten en de andere is een heterogene keten.
Voorbeeld: Molecuulformule C4H10
1.3.Positioneel of positioneel isomerie: Het verschil zit in de positie van een onverzadiging, een functionele groep, een heteroatoom of een substituent.
Voorbeeld: Molecuulformule C4H6

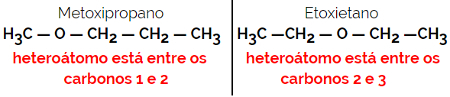
1.4.Compensatie isomerie of metamery: Het is een speciaal type positie-isomerisme, waarbij het verschil de positie van het heteroatoom is.
Voorbeeld: Molecuulformule C4H10O
1.5.Dynamische isomerie of tautomerie: Het is een speciaal type functie-isomerisme, waarbij de isomeren in dynamisch evenwicht in oplossing naast elkaar bestaan. De twee belangrijkste soorten tautomerie zijn tussen een keton en een enol (ketoenolbalans) en tussen een aldehyde en een enol (aldoenolbalans).
Voorbeeld: Molecuulformule C3H6O
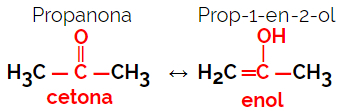
2. Ruimte-isomerisme of steroisomerie: In dit geval kan het verschil tussen de isomeren alleen worden gevisualiseerd door de oriëntatie van hun atomen in de ruimte. Er zijn twee soorten stereo-isomerie: geometrische isomerie en optische isomerie.
2.1.Geometrische of cis-trans-isomeren: Het verschil is dat de isomeer genoemd als cis het heeft dezelfde koolstofliganden in een dubbele binding of in cyclische verbindingen aan dezelfde kant van het vlak. De isomeer liganden trans zijn aan weerszijden.
Voorbeeld: Molecuulformule C2H2kl2

Deze verbindingen worden genoemd stereo-isomeren.
2.2.optische isomeer: Doet zich voor wanneer isomeren een bundel gepolariseerd licht kunnen afbuigen. Als het de gepolariseerde lichtbundel naar links buigt, is het een linksdraaiend isomeer, maar als het naar rechts buigt, wordt het een rechtshandig isomeer genoemd.
Voorbeeld:
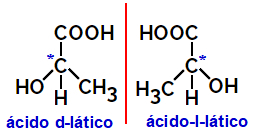
Asymmetrische moleculen zoals de hierboven getoonde, die spiegelbeelden van elkaar zijn en die niet over elkaar heen kunnen worden gelegd, worden enantiomeren.
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/tipos-isomeria.htm

