wordt genoemd ionenstraal de grootte van een ion. De studie van deze eigenschap is afhankelijk van kennis over atomaire straal en ionen.
Atoomstraal: is een maat voor de grootte van een neutraal atoom (theoretische afstand van de kern tot de laatste elektrosfeer).
ionen: atomen die verliezen (kationen) of elektronen krijgen (anionen).
Protonen in de kern van a atoom een aantrekkingskracht uitoefenen op de in de elektrosferen aanwezige elektronen (negatieve deeltjes). Hoe groter het aantal protonen, hoe groter deze aantrekkingskracht en vice versa. Wanneer het aantal elektronen in een atoom wordt gewijzigd door een verlies of winst van deze deeltjes, wordt de aantrekkingskracht tussen protonen en elektronen als volgt gewijzigd:
In het geval van een kation:
Het aantal elektronen in de elektrosferen wordt kleiner dan het aantal protonen in de kern, de waardoor de aantrekkingskracht van de kern groter wordt en de elektronen er dichter naar toe worden getrokken. elektrosferen. Het resultaat is een afname van de straal van het atoom. De straal van een kation zal dus altijd kleiner zijn dan de straal van zijn neutrale atoom.
Neutrale atoomstraal > Kationstraal
In het geval van een anion:
Het aantal elektronen in de elektrosferen wordt groter dan het aantal protonen in de kern. In dit geval wordt de aantrekkingskracht van de kern overwonnen door de afstotende kracht tussen de elektronen die in de elektrosferen aanwezig zijn, met als resultaat een toename van de straal van het atoom. De straal van een anion zal dus altijd groter zijn dan de straal van zijn neutrale atoom.
Anionstraal > Neutrale atoomstraal
De twee onderstaande situaties zijn een goed voorbeeld van wat er gebeurt met de straal van een ion:
1e) Neutraal natriumatoom (11Na) en het natriumkation (11Bij+)
Terwijl het neutrale natriumatoom elf protonen (gele bollen) en elf elektronen (rode bollen) heeft, heeft het natriumkation elf protonen en tien elektronen.

Natriumneutraal atoommodel
Wanneer het neutrale natriumatoom een elektron verliest, neemt de straal af.
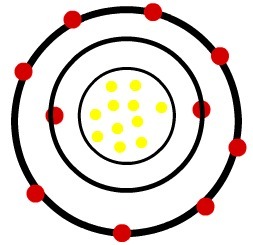
Model van een natriumkation
Observatie: Het derde niveau werd niet weergegeven in het beeld van het kation omdat het, omdat het het enige elektron dat het had, verloor, leeg werd en daarom werd genegeerd, maar het is aanwezig.
2e) Fosfor neutraal atoom (15P) en het fosforkation (15P-3)
Terwijl het neutrale fosforatoom vijftien protonen (gele bollen) en vijftien elektronen (rode bollen) heeft, heeft het fosforanion vijftien protonen en achttien elektronen.
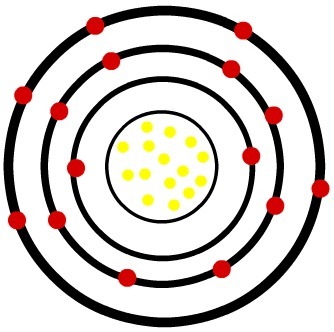
Model van een neutraal fosforatoom
Wanneer het neutrale fosforatoom drie elektronen krijgt, neemt de straal toe.
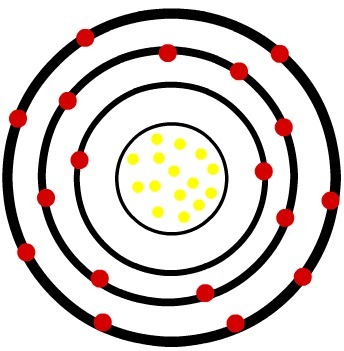
Model van een anion van de fosfor
Door mij Diogo Lopes Dias