DE Chemische kinetica is een veld dat de factoren bestudeert die de snelheid van ontwikkeling van chemische reacties beïnvloeden, dat wil zeggen de snelheid waarmee ze plaatsvinden. Er is steeds meer onderzoek op dit gebied, omdat we vaak sommige reacties willen versnellen of andere willen vertragen. Dit is vooral belangrijk voor industrieën en dit onderzoek heeft belangrijke technologische consequenties.
Maar aangezien de snelheid van een reactie in elk tijdsinterval en van de ene stof tot de andere kan variëren, is het gebruikelijk om de. te berekenen gemiddelde reactiesnelheid.
Beschouw de volgende generieke reactie, waarin de coëfficiënten de kleine letters zijn en de reactanten en producten worden weergegeven door de hoofdletters:
a A + b B → c C + d D
De gemiddelde snelheid van deze reactie wordt gegeven het delen van de gemiddelde reactiesnelheid van een van de reagerende stoffen of de gemiddelde snelheid van vorming van een van de producten door de respectieve coëfficiënt in de chemische vergelijking. Dit wordt gegeven door:
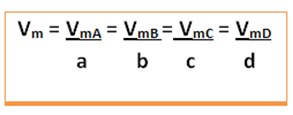
Beschouw bijvoorbeeld de ontledingsreactie van waterstofperoxide:
twee uur2O2(aq) → 2 H2O(1) + 1 O2 (g)
Laten we zeggen dat in 1 minuut 0,3 mol/L H werd gevormd2O en 0,15 mol/L O2, terwijl 0,3 mol/L H ontbonden2O2, dat wil zeggen, de gemiddelde afbraak- en vormingssnelheden van deze stoffen in de reactie zijn:
VmH2O2 = 0,3 mol/L. min
VmH2O = 0,3 mol/L. min
VmO2 = 0,15 mol/L. min
De gemiddelde snelheid van de globale reactie wordt gevonden door een van deze waarden te nemen en deze te delen door de respectieve coëfficiënt in de vergelijking:
Vm = VmH2O2 = 0,3 mol/L. min = 0,15 mol/L. min
2 2
Vm = VmH2O = 0,3 mol/L. min = 0,15 mol/L. min
2 2
Vm = VmO2 = 0,15 mol/L. min = 0,15 mol/L. min
1 1
Merk op dat de drie waarden gelijk zijn, daarom is de reactiesnelheid hetzelfde als een functie van een reactant of product, in hetzelfde tijdsinterval.
Hoe werden echter de waarden van de gemiddelde snelheden van elk van de bij deze reacties betrokken stoffen gevonden?
Het kan worden berekend de variatie in de concentratie van de stof (reagens of product) te delen door het tijdsinterval. Als we de gemiddelde snelheid van een van de of reagentia van de reactie, zullen we een negatief teken eerder, of overweeg anders de concentratiewaarde: in module ||, aangezien, aangezien de concentratie van de reactant in de loop van de tijd afneemt, de snelheidswaarde negatief zou zijn, maar er is geen negatieve snelheid.

Beschouw bijvoorbeeld de volgende ontledingsreactie van ozongas (O3(g)) in zuurstofgas (O2(g)):
2 O3(g) → 3 O2(g)
Laten we zeggen dat er in een ballon 10 mol ozongas zat, maar na 1 minuut waren er nog maar 4 mol over; dit betekent dat 6 mol ozon werd omgezet in zuurstofgas. Dus we hebben:
2 O3(g) → 3 O2(g)
t = 0 min 2 mol/L 0 mol/L
gevormde kosten
6 mol/L 9 mol/L
t = 1 min 4 mol/L 9 mol/L
Merk op dat aangezien de reactieverhouding 2:3 is, als 6 mol O werd gebruikt3, 9 mol O gevormd2. Dus na 1 minuut hebben we de volgende gemiddelde snelheden:
Vm = - [De3]
t
Vm = - ([O3finale - O3initiaal])
tLaatste - teerste
Vm = - ([4 - 10])
1– 0
Vm = 6mol/L. min→ Gedurende 1 minuut reageerde 6 mol ozon in elke liter van het systeem.
Vm = [De2]
t
Vm = ([O2e finale - O2initial])
tLaatste - teerste
Vm = ([9 - 0])
1– 0
Vm = 9 mol/L. min→ Gedurende 1 minuut werden in elke liter van het systeem 9 mol zuurstof gevormd.
Hieruit blijkt dat we de gemiddelde snelheid kunnen berekenen als functie van de reactanten of als functie van de producten.
Als we nu de gemiddelde snelheid van deze globale reactie willen berekenen, doe dan wat we aan het begin hebben laten zien: deel elk van deze snelheden door hun respectievelijke coëfficiënten in de chemische vergelijking:
Vm = VmO3 = 6mol/L. min = 3mol/L. min
2 21
Vm = VmO2 = 9mol/L. min = 3mol/L. min
3 3
Vm = VmO3 = VmO2
23
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/velocidade-das-reacoes-quimicas.htm