O atomaire straal (r) wordt meestal gedefinieerd als halve afstand tussen twee kernen van naburige atomen, zoals de onderstaande afbeelding weergeeft:

atomaire straal
De atoomstraal verschilt van het ene atoom tot het andere, afhankelijk van de familie en periode op het periodiek systeem. Met betrekking tot elementen die behoren tot a dezelfde familie, de atoomstraal neemt toe naarmate het atoomnummer toeneemt., dat wil zeggen, van boven naar beneden. Want in die zin betekent het dat van het ene atoom naar het andere een energieniveau of elektronische laag is toegenomen, dus de straal ervan neemt evenredig toe.
Met betrekking tot het element in dezelfde periode, dat wil zeggen, horizontaal, de straal neemt toe van rechts naar links, of naarmate het atoomnummer afneemt. Dit komt omdat ze allemaal hetzelfde aantal lagen hebben, wat het verschil maakt is het aantal elektronen in deze lagen, en hoe meer elektronen, hoe groter de aantrekkingskracht op de kern, waardoor de straal van de atoom.

Groeirichting van de atoomstraal volgens familie en periode in het periodiek systeem
De atomaire straal kan echter variëren, afhankelijk van de verbinding die wordt gemaakt. Laten we eens kijken hoe dit gebeurt:
*Ionbinding: Als het atoom een vormt kation, de atomaire straal zal afnemenOmdat een of meer elektronen verloren gaan, zal de kern de elektronen intenser aantrekken. Nu als een anion vormen, dwz elektronen winnen, zal de straal van het atoom toenemen, omdat de totale lading van de elektrosfeer groter zal zijn dan de totale lading van de kern, waardoor de aantrekkingskracht afneemt. Hoe meer elektronen u wint of verliest, hoe groter de variatie in de grootte van de straal zal zijn.
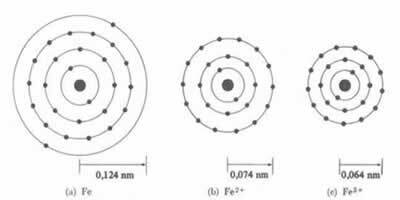
De diameter of straal van het kation is altijd kleiner dan de diameter of straal van het atoom
Ook in een reeks van iso-elektronische ionen, die dezelfde hoeveelheid elektronen en energieniveaus hebben, zal het ion met het kleinste atoomnummer een grotere straal hebben. Bijvoorbeeld, de ionen 13Al3+, 12mg2+, 11Bij1+, 9F-1, 8O2- en 7nee-3, hebben allemaal 10 elektronen en 2 elektronische niveaus. Maar wat de grootste straal heeft, is de 7nee-3, omdat het het kleinste atoomnummer heeft (Z= 7).
*Covalente binding: Als twee atomen een covalente binding vormen, als de twee atomen gelijk zijn, zoals in het geval van waterstofgas (H2), men kan spreken van een covalente straal (r), die de helft is van de lengte van de binding (d), dat wil zeggen, de helft van de afstand tussen de twee kernen. Hoewel, als de binding is gemaakt door verschillende atomen, zoals in het geval van waterstofchloride (HCl), de lengte of afstand (d) is de som van de covalente stralen (r1 + r2) van de atomen die bij de covalentie betrokken zijn.
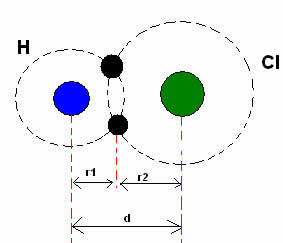
Som van atoomstralen in een covalente binding.
Natuurlijk moeten we niet vergeten dat dit probleem veel gecompliceerder is, omdat de covalente straal van een atoom kan variëren als het zich bindt met andere verschillende atomen.
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/variacao-raio-atomico-ligacoes-quimicas.htm


