Lorenzo Romano Amedeo Carlo Avogadro (1776-1856) was een Italiaanse chemicus die voor het eerst het idee vestigde dat een monster van een element, met massa in gram numeriek gelijk aan zijn atomaire massa, heeft altijd hetzelfde aantal atomen (N).
Avogadro zelf was niet in staat om de waarde van N. Gedurende de twintigste eeuw maakten de vooruitgang van technologie en wetenschappelijke kennis het echter voor andere wetenschappers mogelijk technieken te ontwikkelen om dit te bepalen. Toen deze waarde uiteindelijk werd ontdekt, heette het constante van Avogadro, ter ere van deze wetenschapper, want hij was het die de basis legde voor de oprichting ervan.

Lorenzo Romano Amedeo Carlo Avogadro (1776-1856)
In 1 mol van elke entiteit (atomen, moleculen, elektronen, formules of ionen) zit precies de waarde van de constante van Avogadro.
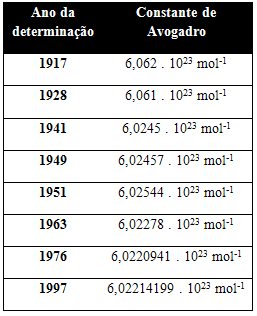
De onderstaande tabel toont enkele waarden voor de constante van Avogadro die in de 20e eeuw is verkregen:
Hier zijn enkele van de technieken die worden gebruikt om te proberen de waarde van de constante van Avogadro te bepalen:
De eerste wetenschapper die bij benadering een berekening maakte voor de constante van Avogadro was Johann Joseph Loschmidt. In het jaar 1867 baseerde hij zich op de kinetische theorie van gassen en bepaalde hoeveel moleculen er in 1 cm. bestonden3 van een aardgas.
Een andere van deze wetenschappers was de Fransman Jean Baptiste Perrin (1870-1942) die het aantal colloïdale deeltjes per volume-eenheid in een suspensie telde en hun massa mat. De waarde die hij vond lag tussen de 6,5 en 7,2. 1023 entiteiten per mol. Deze wetenschapper publiceerde in 1913 het boek Les Atomen (1e ed. Paris: Alcan), en de 9e editie, gepubliceerd in 1924, bevatte 16 manieren om experimenteel de constante van Avogadro te verkrijgen.

Jean Baptiste Perrin (1870-1942)
Jaren later gebruikte wetenschapper James Dewar (1842-1923) een methode die jaren eerder was ontwikkeld door radiochemicus Bertram Boltwood (1870-1927) en natuurkundige Ernest Rutherford (1871-1937), die in feite bestond uit het tellen van de alfadeeltjes die door een radioactieve bron worden uitgezonden en het bepalen van het verkregen volume heliumgas. De door Dewar gevonden waarde was 6,04. 1023 mol-1.
In de 20e eeuw voerde Robert Millikan (1868-1953) een experiment uit om de lading van het elektron te bepalen (1.6. 10-19 ). Omdat de lading van 1 mol elektronen al bekend was (96500 C), was het mogelijk om deze twee waarden te relateren en de volgende waarde voor de constante van Avogadro te vinden: 6,03. 1023 mol-1.
Momenteel is de aanbevolen waarde voor de constante van Avogadro 6.02214 x 1023 mol-1 en het wordt bepaald door middel van röntgendiffractie, waarbij het volume van enkele atomen van een kristalrooster wordt verkregen, zolang de dichtheid en massa van 1 mol atomen in het monster bekend is.
Voor didactische doeleinden, op de middelbare school, waar berekeningen niet zo nauwkeurig hoeven te zijn als die uitgevoerd in chemische laboratoria, wordt de constante van Avogadro beschouwd als 6,02. 1023 mol-1.
Er zijn ook eenvoudigere methoden die kunnen worden gebruikt om studenten te helpen de constante van Avogadro in de praktijk te bepalen. Een daarvan is door middel van elektrolyse in een waterig medium.
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/determinacao-constante-avogadro.htm