U gassen zij zijn vloeistoffen die, in tegenstelling tot vloeistoffen, alle beschikbare ruimte van de container innemen waar ze zijn opgesloten. De moleculen waaruit de gassen bestaan, kunnen vrij bewegen en interageren met elkaar en met de wanden van de container.
O perfect of ideaal gas het is een geïdealiseerd gas, heeft bijzondere eigenschappen en voldoet aan de algemene gaswet en de Clapeyrons vergelijking.
Kenmerken van perfecte gassen
Er is geen zwaartekracht interactie tussen moleculen;
Bij botsingen onder de moleculen zijn perfect elastisch, dat wil zeggen, er is een totaal behoud van kinetische energie;
Moleculen vertonen een wanordelijke beweging en snelheden die direct afhankelijk zijn van de waarde van de gastemperatuur;
Het juiste volume van elk molecuul is volledig onbeduidend in vergelijking met het totale volume van het gas.
toestandsvariabelen
Druk, temperatuur- en volume zijn de scalaire fysieke hoeveelheden die een gas kenmerken. Deze grootheden worden toestandsvariabelen genoemd en ze onderhouden relaties van evenredigheid.
DE de wet van Boylebepaalt dat de relatie tussen druk en volume van een gas omgekeerd evenredig is. Hoe groter de druk op de moleculen, hoe minder ruimte ze innemen.
DE Wet Gay-Lussacbepaalt dat de relatie tussen het volume en de temperatuur van een gas recht evenredig is. Hoe hoger de temperatuur van een gas, hoe groter de agitatie van de moleculen, die de neiging hebben om uit elkaar te bewegen, waardoor de ruimte die ze innemen groter wordt.
De wet van Charles bepaalt dat de relatie tussen druk en temperatuur van een gas recht evenredig is. Hoe hoger de temperatuur van een gas, hoe groter de moleculaire agitatie. Zo neemt het optreden van botsingen tussen de moleculen en de wanden van de container toe, waardoor de druk van het gas groter wordt.
DE clapeyron-vergelijking het synthetiseert de drie hierboven gepresenteerde wetten en bepaalt een enkele relatie tussen de toestandsvariabelen.
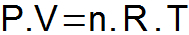
P = gasdruk (atm of N/m2);
V = gasvolume (L of m3);
n = aantal moedervlekken;
R = universele gasconstante (0,082 atm.l/mol. K of 8,31 J/mol. K);
T = gastemperatuur (K).
Ideaal gas in de natuur
De natuur produceert geen gassen die de kenmerken hebben van een perfect gas. Het ideale gas is een theoretisch en bruikbaar model voor het begrijpen van het gedrag van gassen in het licht van veranderingen in hun kenmerken.
Door Joab Silas
Afgestudeerd in natuurkunde
Bron: Brazilië School - https://brasilescola.uol.com.br/o-que-e/fisica/o-que-e-gas-perfeito.htm

