DEosmose en de oplosmiddel doorgang, van een minder geconcentreerde oplossing naar een meer geconcentreerde oplossing, via a semipermeabel membraan, totdat de door de oplossing op het membraan uitgeoefende druk de doorgang van oplosmiddel verhindert. Dit proces is bedoeld om de concentratie van de oplossing in evenwicht brengen.
Lees ook: Opgeloste en oplosmiddel
osmotische druk
DE osmotische druk en de druk uitgeoefend op de oplossing met grotere concentratie zodat er geen osmose optreedt, dat wil zeggen dat het oplosmiddel het semi-permeabele membraan niet passeert.
Osmotische druk wordt gebruikt in processen van ontzilting van water, waardoor het proces van omgekeerde osmose, waardoor het oplosmiddel van de meer geconcentreerde oplossing naar de minder geconcentreerde oplossing gaat. Dit proces noemen we omgekeerde osmose. Zie de volgende afbeelding die de twee processen vergelijkt:
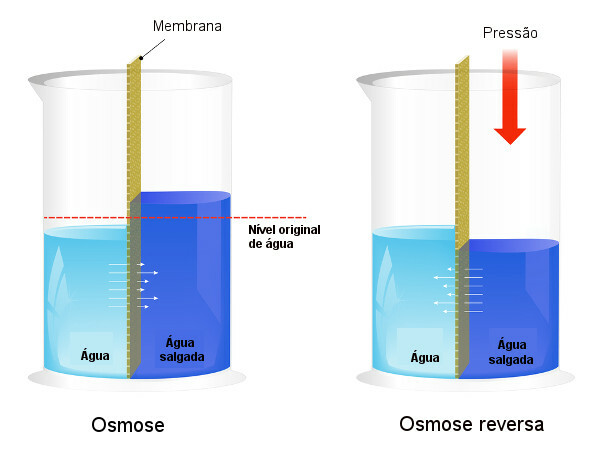
Merk op dat bij osmose de doorgang van het oplosmiddel in de richting van de meest geconcentreerde oplossing is en dat bij omgekeerde osmose de doorgang in de tegenovergestelde richting is vanwege de uitgeoefende druk. Lees onze tekst voor meer informatie over het onderwerp: osmotische druk.
meer weten: Omgekeerde osmose bij de ontzilting van zeewater
osmotische drukvergelijking:
Osmotische druk, weergegeven door de letter pi (π) van een oplossing, kan worden berekend met de volgende vergelijking:
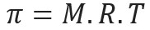
M = concentratie in mol/L
R = universele constante van perfecte gassen
T = absolute temperatuur, in K
zoals anderen colligatieve eigenschappen, de osmotische druk hangt af van de oplossing concentratied.w.z. hoe groter de concentratie van de oplossing, hoe groter het effect van osmose op de oplossingen en dus hoe groter de osmotische druk.
Voorbeelden
Osmose komt op verschillende tijdstippen voor in ons dagelijks leven. We kunnen het voorbeeld noemen van vlees zouten proces aan jouw behoud. U micro-organismen dat zou leiden tot afbraak van vlees water verliezenvan binnen naar buiten, die een zoutconcentratie heeft, waardoor het voedsel langer houdbaar is.
Door het zout komt het ook voor dat de blaadjes van een salade verdorren voor het verliezen van water uit de binnenkant van hun cellen (soort minder geconcentreerd) voor de geharde oplossing in de externe omgeving.
Osmose is ook belangrijk als we het hebben over de bloed menselijk. We zeggen dat de Rode cellen en het bloed is één isotoon medium, dat wil zeggen, ze hebben dezelfde osmotische druk, waardoor water gemakkelijk de cel kan binnenkomen en verlaten.
Wanneer het bloed echter minder geconcentreerd wordt dan in de rode bloedcellen (hypotoon medium), zal de doorgang van water gemakkelijker in de cel plaatsvinden, waardoor het zwellen tot barsten. Als het bloed een concentratie bereikt die hoger is dan de concentratie van de rode bloedcel (hypertoon medium), bloedcellen verdorren, omdat ze water verliezen.

Volgens hetzelfde principe van vleesconservering, fruitconserveringin de snoepcompotes, die voedsel bewaren vanwege hoge suikerconcentratie bij de oplossing.
Hieronder volgen andere voorbeelden waarbij osmose optreedt:
- bij het opstijgen van sap in de geleidende vaten van de plant;
- Bij hemodialyse;
- bij de selectieve passage van voedingsstoffen in de cellen van het menselijk lichaam.
Om te begrijpen hoe osmose plaatsvindt in de dierlijke cel, de plantencel en andere biologische zaken, lees: Osmose: wat het is en hoe het voorkomt in de dierlijke en plantaardige cel.
Door Victor Ferreira
Scheikundeleraar
