Bij gewone batterijen worden genoemd Leclanché-batterijen genoemd naar zijn uitvinder, de Franse chemicus George Leclanché (1839-1882).

George Leclanché (1839-1882)
Leclanché creëerde dit type batterij in het jaar 1866. Ze heet ook droge cel want tot dan toe waren er alleen batterijen die waterige oplossingen gebruikten, zoals: De stapel van Daniell.
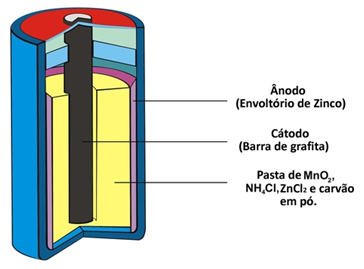
Twee andere namen die dit type stapel krijgt vanwege zijn samenstelling zijn: zuur stapel of zink-koolstofbatterij. Het wordt in wezen gevormd door een zinkomhulsel dat door middel van een poreus papier is gescheiden van de andere chemische soorten die de stapel vormen.
Dit zink komt overeen met de negatieve pool van de cel of anode, terwijl het oxideert en twee elektronen verliest, volgens de onderstaande semi-reactie:
Negatieve pool - anode: Zn (en) → Zn2+(hier) + 2 en-
Deze stapel heeft ook een positieve pool, de kathode, een grafietstaaf die in het midden van de stapel is geïnstalleerd, omringd door mangaandioxide (MnO2), houtskoolpoeder (C) en een natte pasta met ammoniumchloride (NH4Cl), zinkchloride (ZnCl2) en water (H2O).
Ammoniumchloride en zinkchloride zijn zouten met een zuur karakter, vandaar de naam “zuurcel”.
De grafietstaaf geleidt de door zink verloren elektronen naar mangaan, waardoor mangaandioxide (MnO) wordt verminderd2) naar mangaantrioxide (Mn2O3), volgens de volgende semi-reactie:
Positieve pool - Kathode: 2 MnO2(aq) + 2 NH41+(hier) + 2e- → 1 Mn2O3(en) + 2NH3(g) + 1 uur2O(1)
De natte pasta werkt als een zoutpunt, waardoor de migratie van hydroxylanionen (OH-) van grafiet naar zink.
De totale reactie wordt gegeven door:
Zn (en) + 2 MnO2(aq) + 2 NH41+(hier) → Zn2+(hier) + 1 mnd2O3(en) + 2NH3(g)
Als zodanig zijn deze batterijen niet oplaadbaar omdat al het mangaandioxide wordt omgezet in mangaantrioxide. Wanneer de batterij niet meer werkt, moet deze worden weggegooid.
De ddp van deze batterijen is 1.5V. Echter, ammoniak (NH3(g)) gevormd aan de kathode kan worden afgezet op de grafietstaaf, waardoor de doorgang van elektronen wordt belemmerd en de spanning van de batterij wordt verlaagd. Om terug te keren naar de normale werking, laat u de batterij gewoon buiten het apparaat rusten, omdat het zink-kation (Zn2+(hier)) gevormd aan de anode reageert met ammoniak, waardoor de grafietstaaf vrij blijft.
Daarnaast kan het plaatsen van de stapel in de koelkast ook helpen, omdat het verlagen van de temperatuur de oplosbaarheid van ammoniak in de vochtige pasta in de stapel bevordert.
Een andere belangrijke factor over droge Leclanché-cellen waarmee we rekening moeten houden, is dat: de zinken behuizing kan corroderen en zo het corrosieve materiaal lekken en het apparaat beschadigen.. Daarom is het het beste om de batterijen niet in apparaten te laten zitten die niet continu worden gebruikt.
Droge batterijen zijn geïndiceerd voor apparatuur die licht en continue ontlading nodig heeft, zoals afstandsbediening, wandklok, draagbare radio en speelgoed.
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/pilha-seca-leclanche.htm
