De elementen van familie 17 of VII A van het periodiek systeem worden Halogenen genoemd, weergegeven door de vijf onderstaande elementen: Fluor (F), Chloor (Cl), Broom (Br), Jodium (I) en Astatine (At). Ze worden vaak generiek weergegeven met de letter X.

De belangrijkste zijn vanwege hun dagelijkse toepassingen chloor, broom en jodium.
Deze naam "halogeen" betekent "zoutvormend".
Ze hebben allemaal 7 elektronen in de valentieschil (elektronische schil buitenste van de kern en energieker). Algemeen: ns2 np5. Als gevolg hiervan hebben ze de neiging een elektron te ontvangen en negatieve eenwaardige ionen te vormen (X-1), voornamelijk reageren met alkalimetalen (familie 1 metalen), die de neiging hebben om een elektron af te staan. Zo ontstaan verbindingen met formules van het MX-type.

Door dit elektron te winnen, zijn de halogenen stabiel, omdat hun valentieschil compleet is (met acht elektronen) en hun kenmerken volledig veranderen. Bijvoorbeeld chloorgas (Cl2) is een groenachtig geel, dicht, zeer giftig en reactief gas, slecht oplosbaar in water en explosief reagerend met waterstof. Echter, wanneer de
chloor- (Cl) ontvangt een elektron van natrium (Na), ze worden ionen en vormen natriumchloride (NaCl), of tafelzout, dat we dagelijks binnenkrijgen en dat nodig is om ons leven te ondersteunen. Chloor wordt vooral het chloride-ion (Cl-) die in ons lichaam nodig is voor de vorming van zoutzuur (HCl), het hoofdbestanddeel van ons maagsap.In feite is chloor de meest voorkomende van de halogenen en wordt het gebruikt bij de productie van organische verbindingen, anorganische stoffen, in de papierfabricage (gericht op het bleken van pulp) en in water en riolen. Het is ook gebruikelijk om een waterige oplossing van natriumhypochloriet (NaClO) te gebruiken, die "vloeibaar chloor" wordt genoemd en die in de samenstelling van bleekwater zit.
Een interessant feit is dat hoewel sommige mensen zeggen dat "vast chloor" wordt gebruikt in zwembaden, het eigenlijk niet alleen het element chloor is, maar calciumhypochloriet (Ca (ClO)2).
Een soortgelijk geval is ook het gebruik van fluor – wat eigenlijk niet per se fluor is, maar fluoriden (ionische verbindingen die het element fluor bevatten) – in de drinkwaterbehandeling en in mondverzorgingsproducten.
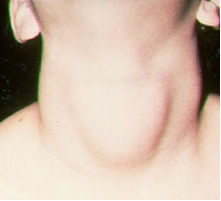
Met respect voor de jodiumEen belangrijke toepassing is de wettelijk verplichte toevoeging (in de vorm van jodiden of natrium- en kaliumjodaten) aan keukenzout. Dit komt omdat het gebrek aan jodium in het lichaam een ziekte kan veroorzaken die struma wordt genoemd, in de volksmond bekend als papo.
O broom het is een rode vloeistof, bij kamertemperatuur, dicht en onstabiel en, omdat het vluchtig is, kan het verdampen en een roodachtige damp vormen. Het wordt niet geïsoleerd in de natuur aangetroffen en wordt ook niet op deze manier in de industrie gebruikt. De belangrijkste toepassingen van de verbindingen zijn: als katalysator voor organische reacties, gemengd met brandstoffen, onder meer in fotografische ontwikkelingen.
al de astatine het is een radioactief element. De oorsprong ervan is meestal het gevolg van het radioactieve verval van uranium- en thoriumisotopen. Het vormt ten minste 20 isotopen, waarvan At-210 de meest stabiele is, met een halfwaardetijd van 8,3 uur. Het is een zeer zeldzaam element.
Door Jennifer Fogaça
Afgestudeerd in scheikunde
