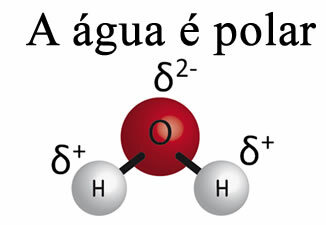
Water alleen kan geen vet van materialen verwijderen. Dit is zo omdat Dewater is polair, zoals weergegeven in de onderstaande afbeelding, vanwege het verschil in elektronegativiteit dat bestaat tussen de waterstof- en zuurstofatomen van hun moleculen. Aan de andere kant, het vet is niet-polair en daarom lost water geen vetten op.
Bovendien heeft water iets genaamd oppervlakkige spanning. In de tekst kun je dit beter begrijpen. Oppervlaktespanning van water, maar eigenlijk is het een soort elastische film of membraan dat zich op het wateroppervlak vormt, waardoor het niet in stoffen en andere materialen kan doordringen om vuil te verwijderen. Watermoleculen trekken elkaar in alle richtingen aan door middel van waterstofbruggen, maar oppervlaktemoleculen hebben alleen interactie met moleculen aan de zijkant en onderkant, waardoor een verschil in cohesie krachten, waardoor de oppervlaktemoleculen samentrekken en deze oppervlaktespanning vormen.
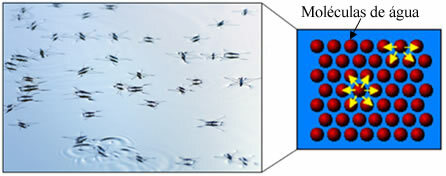
Dat is waar zepen en wasmiddelen binnenkomen (van het Latijn
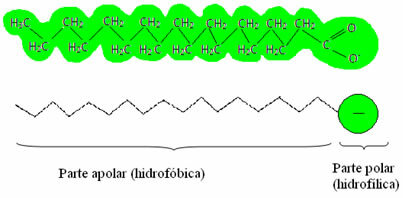
ontgiften = helder), die ook wel. worden genoemd oppervlakteactieve stoffen, omdat ze het vermogen hebben om de oppervlaktespanning van water te verlagen en bovendien een interactie aangaan met zowel water als vet. Hoe gebeurde dit?Zepen en wasmiddelen bevatten vetzuurzouten, dit zijn lange moleculen gevormd door a niet-polaire deel (wat is hydrofoob – waterkracht = water; fobisch = afkeer) en a polair einde (hydrofiel – waterkracht = water; phyla = vriend). Hieronder hebben we een typische opbouw van een zeep:
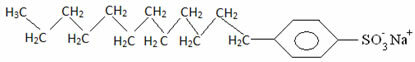
Over het algemeen zijn detergentia zouten van sulfonzuren met een lange keten:
Zo interageert het niet-polaire deel van deze moleculen dat aanwezig is in zepen en wasmiddelen met het vet, terwijl het polaire uiteinde in wisselwerking staat met water, zich groepeert in kleine bolletjes, gebeld vanuit micellen, waarbij de hydrofiele delen naar de buitenkant van de micel zijn gericht in contact met de watermoleculen, en de vet blijft aan de binnenkant, in contact met het niet-polaire of hydrofobe deel, een proces vergelijkbaar met dat in de afbeelding a volgen:
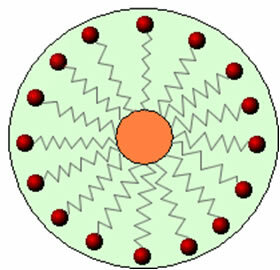
Op deze manier wordt het vettige vuil in het midden van de micellen gevangen en kan het worden verwijderd. Een ander punt is dat wasmiddelen en zepen het vermogen hebben om de oppervlaktespanning van water te verlagen, omdat: de interacties tussen zijn moleculen verminderen, waardoor het gemakkelijker wordt om verschillende materialen binnen te dringen om de aarde.
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/quimica-dos-saboes-detergentes.htm
