DE gemeenschappelijke concentratie, ook wel concentratie in g/L genoemd, is de verhouding tussen de massa opgeloste stof in een volume oplossing.
Wiskundig wordt de gebruikelijke concentratie uitgedrukt door de formule:
C = m/v
Waar,
C: gemeenschappelijke concentratie;
m: massa van de opgeloste stof;
V: volume oplossing.
De meest gebruikte eenheid voor algemene concentratie is g/L, aangezien de massa van de opgeloste stof wordt berekend in gram (g) en het volume van de oplossing in liters (L).
Zeewater heeft bijvoorbeeld een grote hoeveelheid opgeloste zouten en natriumchloride (NaCl), in de volksmond bekend als tafelzout, is daar een van.
De concentratie natriumchloride in zeewater is gemiddeld 2,5 g/L. Er zit dus 2,5 gram zout, wat de opgeloste stof is, in elke 1 liter zeewater, wat de oplossing is.
Hoe gemeenschappelijke concentratie berekenen?
Een oplossing is een homogeen mengsel gevormd door een stof in kleinere hoeveelheid, opgeloste stof genaamd, opgelost in een oplosmiddel, dat in grotere hoeveelheid aanwezig is.
Daarom verwijst gemeenschappelijke concentratie naar de hoeveelheid opgeloste stof in een bepaald volume oplossing. Hoe meer opgeloste stof in de oplossing is opgelost, hoe geconcentreerder deze is. Anders, dat wil zeggen, lage opgeloste stof geeft aan dat de oplossing is verdund.
voorbeeld 1: Wat is de concentratie in g/L van een oplossing van zilverjodide (AgI) die 2,6 g in 1L oplossing bevat?
Wanneer we de hoeveelheid opgeloste stof en het volume van de oplossing geven, pluggen we de waarden eenvoudig in de algemene concentratieformule om de waarde ervan te vinden.
Daarom is er in een 2,6 g/L-oplossing van zilverjodide 2,6 g opgeloste stof in elke 1 liter oplossing.
Voorbeeld 2: Wat is de massa van de opgeloste stof die wordt verkregen wanneer het oplosmiddel wordt verdampt uit 500 ml zoutoplossing met een concentratie van 6 g/L?
Merk op dat we in sommige berekeningen de algemene beschreven concentratie kunnen vinden, zodat we de massa van de opgeloste stof kunnen berekenen.
Het is ook noodzakelijk om aandacht te besteden aan de eenheden. Omdat de gebruikelijke concentratie wordt gegeven in g/L, moeten we in dit geval de eenheid van volume omrekenen voordat we de formule toepassen.
Omdat 1 L 1000 ml bevat, komt 500 ml overeen met 0,5 L.
Dus bij het verdampen van het oplosmiddel uit de oplossing met een concentratie van 6 g/l, werd 12 g opgeloste stof verkregen.
Meer kennis opdoen met de inhoud:
- Oplossing concentratie
- molaire concentratie
- Verdunning van oplossingen
Veelvoorkomende concentratieoefeningen opgelost
Gebruik de volgende vragen om de eerder opgedane kennis te controleren.
vraag 1
(Unicamp) Het oplosmiddel wordt volledig verdampt uit 250 ml van een waterige oplossing van MgCl2 van concentratie 8,0 g/L. Hoeveel gram opgeloste stof wordt verkregen?
a) 8.0
b) 6.0
c) 4.0
d) 2.0
e) 1.0
Correct alternatief: d) 2.0.
vraag 2
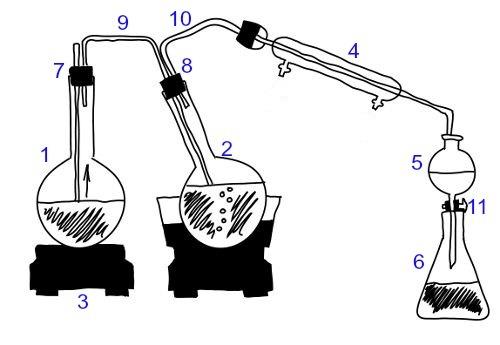
Zie de afbeelding hieronder.

In dit schema bevat container 3 a
a) heterogeen mengsel
b) zuivere stof
c) Oplossing:
d) colloïde mengsel
Correct alternatief: c) Oplossing.
Container 3 bevat een oplossing, een homogeen mengsel gevormd door opgeloste stof en oplosmiddel, waarbij zout de opgeloste stof is en water het oplosmiddel.
Over het algemeen kunnen we zeggen dat de opgeloste stof de component is in de kleinste hoeveelheid en het oplosmiddel in de grootste hoeveelheid.
Container 1 presenteert een heterogeen mengsel met 3 fasen en container 2 komt overeen met een heterogeen mengsel van 2 fasen.
vraag 3
Er werd een oplossing bereid door 4,0 g magnesiumchloride MgCl. op te lossen2 tot een concentratie van 2,0 g/L is bereikt. Welk volume oplossing werd bereid?
a) 1 L
b) 2 L
c) 4 L
d) 6 L
Correct alternatief: b) 2 L.
Bekijk meer problemen met opgeloste opmerkingen op: veel voorkomende concentratieoefeningen.
Bibliografische verwijzingen
FONSECA, M. R. M. Chemie, 1. 1. red. Sao Paulo: Attika, 2013.
SANTOS, W.L.P; MOL, GS Burgerchemie, 1. 2. red. Sao Paulo: Editora AJS, 2013.
USBERCO, J. Verbind chemie, 1. 2. red. Sao Paulo: Saraiva, 2014.
- Oefeningen over gemeenschappelijke concentratie met feedback met commentaar
- chemische oplossingen
- Opgeloste en oplosmiddel: wat ze zijn, verschillen en voorbeelden
- Oplossing concentratie
- oplosbaarheid
- Molariteit of molaire concentratie: wat het is, formule en hoe te berekenen
- Verdunning van oplossingen
- Oefeningen over eigenschappen van materie